Uvod
Moždani udar (MU) jedan je od vodećih uzroka pobola i smrtnosti u razvijenome svijetu. Unatoč napretku u prepoznavanju čimbenika rizika i kliničkome zbrinjavanju pacijenata, prevalencija i incidencija MU-a nisu na zadovoljavajućoj razini (1,2). Anamneza i klinički status uz neuroslikovne metode prikaza mozga najznačajnije su za dijagnozu moždanoga udara, a kao nadopuna navedenomu, od koristi može biti i evaluacija biomarkera za procjenu oštećenja tkiva. Kako jedan od uzroka MU-a mogu biti i promjene u sustavu hemostaze, pretrage protorombinsko vrijeme (PV), internacionalni normalizirani omjer (engl., International Normalized Ratio – INR), aktivirano parcijalno tromboplastinsko vrijeme (APTV), fibrinogen i D-dimeri (DD) učestalo se određuju u bolesnika kod kojih se sumnja na hiperkoagulabilno stanje ili mogući povećani rizik krvarenja.
Promijenjene vrijednosti globalnih testova zgrušavanja PV-a i APTV-a mogu ukazati na abnormalno krvarenje ili zgrušavanje, ali se i upotrebljavaju u smislu slijeda i titriranja propisane protuzgrušavajuće terapije poput varfarina ili heparina u pacijenata s MU-om.
Nekoliko kliničkih studija objavilo je povezanost između koncentracije fibrinogena i prognoze akutnoga moždanog udara (3-6). Fibrinogen je marker upale, a njegovo nakupljanje može ubrzati trombozu. U bolesnika kod kojih imunološki sustav reagira intenzivnije izgleda da postoji i veći rizik od ponovnih vaskularnih incidenata i smrti (3-6). Stoga i visoke koncentracije fibrinogena mogu pružiti informaciju o mogućem riziku, neovisno o tome što je to dio učinka u sklopu upalnoga odgovora u ishemijskome MU-u (3-6). Nadalje, istraživanja su pokazala da osim povećanoga stvaranja fibrina, u akutnome MU-u dolazi i do poremećaja fibrinolitičke aktivnosti (7). Razgradnja fibrina rezultira stvaranjem raznih topivih razgradnih produkata koji se razlikuju prema svojoj molekularnoj težini. Najmanji i najbolje okarakterizirani produkti jesu D-dimeri (DD) (8). Pretraga D-dimeri ima svoje mjesto u dijagnostičkoj obradi bolesnika sa suspektnom venskom tromboembolijom (VTE) (9,10). Kako D-dimeri imaju slabu specifičnost, ne mogu se upotrebljavati za potvrdu dijagnoze, ali su korisni za isključenje sumnje na VTE (9-11). D-dimeri su istraženi u različitim kliničkim stanjima gdje je prisutna aktivacija koagulacije i fibrinolize te mogu biti korisni i u dijagnostici arterijske tromboze (AT). Visoke vrijednosti D-dimera mogu ukazati na nastanak ugruška unutar moždane žile ili pak biti marker sistemske hiperkoagulabilnosti (12,13). Međutim, imunološka reakcija također uzrokuje simultani porast D-dimera i fibrinogena, te se pretpostavlja da je omjer D-dimera i fibrinogena (DD/F omjer) bolji pokazatelj u smislu procjene rizika ili aktivnosti trombotskoga procesa (14,15).
Promjene u sustavu hemostaze nedvojbeno pridonose razvoju tromboembolijskih i hemoragijskih bolesti, ali korist određivanja nekih rutinskih laboratorijskih koagulacijskih pretraga u akutnome moždanom udaru nije u potpunosti razjašnjena (16,17). Stoga je glavni cilj ovoga rada bio istražiti povezanost između koagulacijskih pretraga koje se uobičajeno određuju po prijemu bolesnika s akutnim moždanim udarom te njihov odnos s (pod)tipovima MU-a i ishodom nakon akutnoga MU-a.
Materijali i metode
Retrospektivno su pregledani podatci o 262 pacijenta suspektnih na akutni moždani udar, hospitaliziranih u razdoblju od siječnja do lipnja 2011. godine na Klinici za neurologiju Zavoda za cerebrovaskularne bolesti Kliničke bolnice „Sveti Duh”. U studiju su uključeni bolesnici s akutnim moždanim udarom i pojavom simptoma unutar 72 sata od prijema. Moždani udar definiran je kao fokalni neurološki deficit s akutnim nastupom, kod kojeg su simptomi vidljivi najmanje 24 sata, što je potvrđeno neuroradiološkom obradom pomoću računalne tomografije (CT) ili magnetske rezonancije (MR) mozga. Klasifikacija moždanoga udara na ishemijski i hemoragijski temelji se na nalazu neuroradiološke obrade, a dodatno je procijenjeno je li se radilo o lakunarnome moždanom udaru. Težina, odnosno ishod moždanoga udara procijenjen je pomoću modificirane Rankinove ljestvicom (18).
Za sve pacijente prikupljeni su podaci o demografskim karakteristikama, rizičnim čimbenicima za moždani udar poput arterijske hipertenzije, hiperlipidemije, šećerne bolesti, fibrilacije atrija, srčane i jetrene bolesti te potencijalne koagulacijske abnormalnosti. Dodatno su analizirani podaci o terapiji, primjeni heparina i sistemskoj trombolizi.
Analizirane su vrijednosti pretraga PV/INR-a, APTVa, fibrinogena, i D-dimera izmjerene po primitku pacijenata. Uzorkovanje krvi obavilo se standardnim postupkom: uzorci skupljeni iz venske krvi u epruvete, koje sadrže 3,2 % natrijeva citrata, odmah su se centrifugirali na 3000 okretaja/minuti kroz 15 minuta. PV-INR, APTV, fibrinogen i D-dimeri mjereni su pomoću analizatora BSC (Siemens Diagnostics, USA). Za sve pacijente izračunat je i omjer D-dimera i fibrinogena. Iz studije su isključeni bolesnici koji su imali recidiv moždanoga udara unutar šest mjeseci i oni kod kojih nismo mogli prikupiti sve potrebne informacije.
Statistika
Za statističku analizu rabljen je program MedCalc (MedCalc 9.4.2.0., Frank Schoonjans, Maraikerke, Belgija). Kontinuirane su varijable prikazane kao medijan
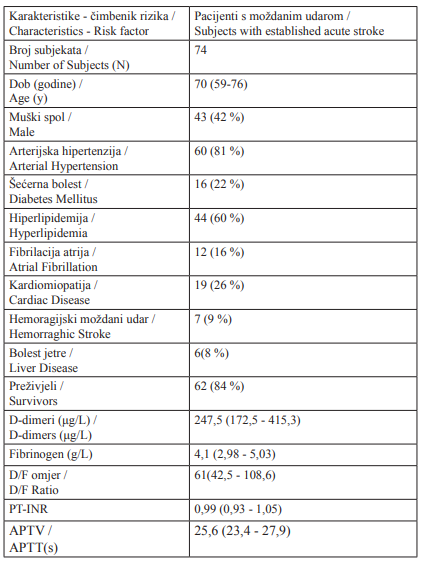
Tablica 1.
Demografske karakteristike, glavni čimbenici rizika i koagulacijski profil pacijenata s moždanim udarom. Podatci o glavnim čimbenicima rizika prikazani su kao brojevi i relativne frekvencije. Dob je izražena u godinama; D-dimeri, fibrinogen, PVINR, APTV i omjer D/F izraženi su kao medijan s interkvartilnim rasponom.
Table 1.
Demographic characteristics, major risk factors and coagulation profile of subjects obtained on admission in study subject with established acute stroke. Data related to the major risk factors are expressed as numbers and relative frequencies. Age of the subjects is expressed in years; D-dimers, fibrinogen, PV-INR, APTV and D/F ratio are expressed as median value with interquartile range.
PT-INR – protrombinsko vrijeme / internacionalni normalizirani omjer
PT-INR – protrombin time international normalized ratio in seconds (s) u sekundama (s)
APTV – aktivirano parcijalno / tromboplastinsko vrijeme
APTT – activated partial tromboplastin time
D/F – omjer D-dimeri / fibrinogen
D/F – ratio of D-dimer to fibrinogen
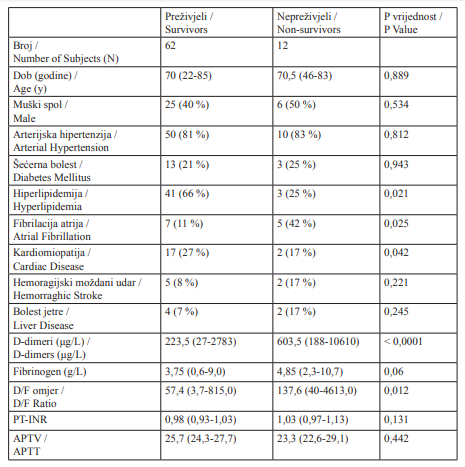
Tablica 2.
Demografske karakteristike, čimbenici rizika i koagulacijski profil pacijenata s akutnim moždanim udarom s obzirom na ishod (preživjeli - nepreživjeli) Podatci o glavnim čimbenicima rizika prikazani su kao brojevi i relativne frekvencije. Dob je izražena u godinama; D-dimeri, fibrinogen, PV-INR, APTV i omjer D/F izraženi su kao medijan s interkvartilnim rasponom.
Table 2.
Demographic characteristics, major risk factors and coagulation profile of subjects obtained on admission in study subject with established acute stroke according to outcome. Data related to the major risk factors are expressed as numbers and relative frequencies. Age of the subjects is expressed in years, D-dimers, fibrinogen, PV-INR, APTV and D/F ratio are expressed as median value with interquartile range.
PT-INR – protrombinsko vrijeme / internacionalni normalizirani omjer
PT-INR – protrombin time international normalized ratio in seconds (s) u sekundama (s)
APTV – aktivirano parcijalno / tromboplastinsko vrijeme
APTT – activated partial tromboplastin time
D/F – omjer D-dimeri / fibrinogen
D/F – ratio of D-dimer to fibrinogen
s interkvartilnim rasponom (25. - 75. percentil), a uspoređene su pomoću Mann-Whitney U testa. Kategorijske su varijable izražene kao apsolutni broj i postotak te su uspoređene pomoću hi-kvadrat testa. Spearmanova korelacija rabljena je za evaluaciju korelacije između mjerenih koagulacijskih parametara i modificirane Rankinove ljestvice. Krivulja Receiver operating characteristic (ROC) i površina ispod krivlje (engl., area under curve, AUC) rabljene su kako bi se evaluirale inicijalne vrijednosti koagulacijskih testova za procjenu rizika od mortaliteta. Statistički značajnim smatrala se P vrijednost manja od 0,05.
Rezultati
Analizirani su podatci o 262 pacijenta, a 74 ih je zadovoljilo kriterije uključenja u studiju. Demografske karakteristike pacijenata prikazane su u Tablici 1. Od ukupnoga broja pacijenata,10 ih je imalo hemoragijski moždani udar, 67 ih je imalo ishemijski moždani udar, a od toga je u 22 pacijenta MU klasificiran kao lakunarni. Izmjerene vrijednosti koagulacijskih pretraga PV-INR i APTV u svih pacijenata po primitku bile su unutar referentnoga raspona, osim razine fibrinogena (medijan 4,1 g/L). Od ukupnoga broja pacijenata njih 61 % imalo je povišeni fibrinogen (> 3,5 g/L), a 16 % povišene vrijednosti D-dimera (> 500 μg/L). Izmjereni medijani koncentracija D-dimera i omjera DD/F redom su bili 248 μg/L i 61. Od ukupnoga broja pacijenata, tijekom hospitalizacije preminulo je 16 % pacijenata.
Nisu nađene statistički značajne razlike između demografskih karakteristika, čimbenika rizika i koagulacijskih pretraga u bolesnika s ishemijskim i hemoragijskim moždanim udarom. S obzirom na preživljenje, hiperlipidemija je kao čimbenik rizika češće zabilježena u preživjelih pacijenata (P = 0,021), dok je fibrilacija atrija bila češće prisutna u pacijenata koji nisu preživjeli (P = 0,025). Medijan vrijednosti D-dimera po primitku statistički je bio značajno viši u pacijenata koji nisu preživjeli u odnosu na one koji su preživjeli (603,5 naspram 223,4 μg/L, P < 0,001). Iako je viša koncentracija fibrinogena zabilježena u pacijenata koji nisu preživjeli, razlika nije bila značajna (4,85g/l naspram 3,75g/l, P = 0,06). Značajno više vrijednosti omjera DD/F nađene su u pacijenata koji nisu preživjeli u odnosu na one koji su preživjeli (138 naspram 57, P = 0,012) (Tablica 2).
Nađena je umjerena, ali statistički značajna korelacija između vrijednosti D-dimera i modificirane Rankinove ljestvice (r = 0,470, CI(r):0.271-0,631; P < 0,0001).
ROC analiza pokazala je AUC za D-Dimere 0,843 s graničnom vrijednosti 376 μg/L (specifičnost 83 %, osjetljivost 81 %, P = 0,0001), za fibrinogen 0,682 s graničnom vrijednosti 4,6 g/L (specifičnost 67 %, osjetljivost 73 %, P = 0,05) te omjera DD/F 0,672 s graničnom vrijednosti 91,5 (specifičnost 67 %, osjetljivost 74 %, P = 0,06).
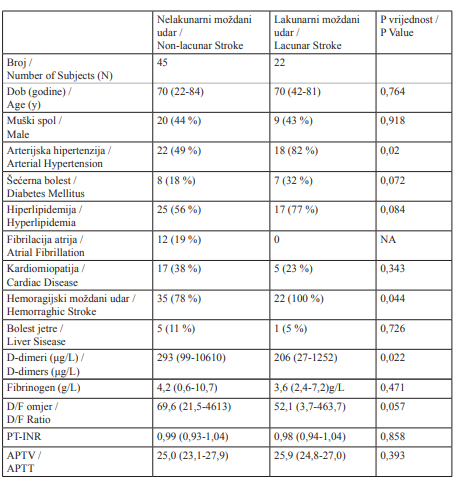
Izmjerene vrijednosti D-dimera u pacijenata s ishemijskim MU-om klasificiranim kao MU nelakunarne etiologije od 294 μg/L, statistički su bile značajno više u odnosu na vrijednosti u pacijenata s MU-om lakunarne etiologije (206 μg /L, P = 0,02). Druge koagulacijske pretrage nisu se značajno razlikovale između pacijenata u tim dvjema skupinama, iako su vrijednosti fibrinogena i omjera DD/F bile više u pacijenata s MU-om koji nije bio lakunarne etiologije (Tablica 3).
Rasprava
Naša je studija pokazala da su vrijednosti D-dimera kod prijema značajno više u pacijenata koji nisu preživjeli u odnosu na pacijente koji su preživjeli akutni moždani udar. Kako D-dimeri predstavljaju marker sistemske hiperkoagulobinosti, oni mogu ukazati na nastanak tromba u moždanoj ili drugoj žili, pa se može očekivati da pacijenti s MU-om imaju povišene vrijednosti Ddimera. Nadalje, slično kao i u drugim istraživanjima, nije iznenađenje da su i u ovoj studiji kod više od pola bolesnika nađene povišene vrijednosti fibrinogena, s obzirom na to da one mogu ukazati na hiperkoagulobilno stanje, što je i jedan od potencijalnih rizičnih čimbenika za MU (3-6). Unatoč tomu nije nađena značajna razlika izmjerenih vrijednosti između pacijenata koji nisu preživjeli u odnosu na pacijente koji su preživjeli. Međutim, D-dimeri, koji su pokazatelji koagulacijske aktivnosti i endogene fibrinolize, također mogu stimulirati upalni proces (15). Budući da upalna reakcija stimulira porast D-dimera i fibrinogena, bilo je očekivano da omjer Ddimera i fibrinogena može biti bolji pokazatelj stratifikacije rizika ili prisutnosti aktivnoga trombotskog procesa.
Iako su statistički značajno više vrijednosti omjera DD/F nađene u pacijenata koji nisu preživjeli MU, ROC analizom nije dobiveno poboljšanje diskriminirajućega potencijala omjera DD/F u smislu specifičnosti i osjetljivosti u odnosu na samo mjerenje D-dimera, kako je to prikazano u drugim istraživanjima. (14,15). Površina ispod krivulje od 0,843 ukazala je na dobro razlikovanje osoba s većim rizikom u smislu preživljenja prilikom granične vrijednosti D-dimera veće od 375 μg/L. Međutim, s obzirom na mali broj pacijenata obrađenih u studiji te činjenicu da se ta vrijednost nalazi ispod preporučene granične vrijednosti od 500 ug/l, dobiveni rezultat treba se tumačiti s oprezom. Svakako bi bilo
Tablica 3.
Demografske karakteristike, glavni čimbenici rizika i koagulacijski profil pacijenata s moždanim udarom s obzirom na vrstu ishemijskoga moždanog udara (lakunarni / nelakunarni). Podatci o glavnim čimbenicima rizika prikazani su kao brojevi i relativne frekvencije. Dob je izražena u godinama; D-dimeri, fibrinogen, PV-INR, APTV i omjer D/F izraženi su kao medijan s interkvartilnim rasponom.
Table 3.
Demographic characteristics, major risk factors and coagulation profile of subjects obtained on admission in study subject according to ischemic stroke subtype. Data related to the major risk factors are expressed as numbers and relative frequencies. Age of the subjects is expressed in years; D-dimers, fibrinogen, PV-INR, APTV and D/F ratio are expressed as median value with interquartile range.
PT-INR – protrombinsko vrijeme / internacionalni normalizirani omjer
PT-INR – protrombin time international normalized ratio in seconds (s) u sekundama (s)
APTV – aktivirano parcijalno / tromboplastinsko vrijeme
APTT – activated partial tromboplastin time
D/F – omjer D-dimeri / fibrinogen
D/F – ratio of D-dimer to fibrinogen
potrebno provesti opširniju studiju kako bi se utvrdila klinički značajna granična vrijednost koja bi poboljšala procjenu rizika pacijenata s akutnim MU-om s ciljem unaprjeđenja njihove skrbi.
Ishod MU-a mjeren modificiranom Rankinovom ljestvicom pokazao je statistički značajnu korelaciju s povišenjem vrijednosti D-dimera, ali ne i s porastom fibrinogena. Prethodne studije pokazale su da povezanost fibrinogena s prognozom MU-a može biti umanjena zbog uloge fibrinogena u akutnoj fazi te potencijalnom povezanosti s drugim uzrocima mortaliteta poput infekcija te općega kliničkog stanja. (3-6).
Fibrilacija atrija bila je češći čimbenik rizika u pacijenata koji nisu preživjeli, kod kojih su bile prisutne i značajno više vrijednosti D-dimera. Dobiveni rezultati svakako su sukladni prethodnim istraživanjima koja su pokazala da je FA povezana s većim rizikom od smrti, zbog snažne povezanosti s tromboembolijskim incidentima (19-21). Međutim, kako značajan postotak pacijenata nakon akutnoga MU-a može imati vensku tromboemboliju, tumačenje nalaza povišenih vrijednosti D-dimera u tih pacijenata može biti dodatno složeno (22-24).
Studije Woodwarda i sur. te Sata i sur. pokazale su da su u odnosu na bolesnike s hemoragijskim MU-om kod bolesnika s ishemijskim MU-om prisutne značajno povišene koncentracije fibrinogena. Međutim, u ovoj studiji nije nađena značajna razlika između koncentracije fibrinogena u bolesnika s ishemijskim i onih s hemoragijskim moždanim udarom (6,25). Slično našem istraživanju Aydin i sur. nisu pronašli značajne razlike u medijanima D-dimera između bolesnika s ishemijskim i hemoragijskim moždanim udarom te su utvrdili da mjerenje koagulacijskih čimbenika nije korisno u razlikovanju između ishemijskoga i hemoragijskoga moždanog udara (26).
U našem istraživanju dodatno su uspoređeni pacijenti s nelakunarnim MU-om (kardioembolijskim MU-om ili bolesti velikih arterija – makroangioaptijom) s bolesnicima s lakunarnim MU-om (mikroangiopatija). Značajno više vrijednosti D-dimera nađene su u bolesnika s nelakunarnim moždanim udarom, što je sukladno studiji Agena i sur. (27). Svi su pacijenti s lakunarnim MU-om preživjeli. Ti su rezultati u skladu s tezom da se arterijska patologija u lakunarnom MU-u razlikuje od drugih uzroka MU-a koji su većinom uzrokovani aterotrombotskim procesom. Netrombotski mehanizam, poput degenerativne lipohijalinoze malih arterija, vjerojatno je vodeći čimenik za razvoj lakunarnoga MU-a (27-31).
Ova je studija pokazala da povišene vrijednosti D-dimera u akutnoj fazi mogu biti povezane s ishodom MU-a. Vrijednosti iznad određenih graničnih vrijednosti (engl. cut-off) mogu biti indikativne za pronalaženje visokorizičnih pacijenata, ali se ti rezultati za sada ne mogu generalizirati na veću populaciju. Glavno ograničenje studije relativno je malen uzorak pacijenata, a u obzir su uzeti samo koagulacijski testovi rađeni kod prijema pacijenata. Nadalje, studija je opservacijska i retrospektivna bez kontrolne skupine, a cilj je studije bio i utvrditi vrijednost određivanja rutinskih koagulacijskih testova po primitku u kliničkoj praksi.
Zaključak
Koagulacijskim testovima ne možemo razlikovati ishemijski od hemoragijskoga MU-a, ali povišene vrijednosti D-dimera povezane su s lošijom prognozom nakon akutnoga MU-a, kao i s MU-om koji nije lakunarne etiologije. Određivanje D-dimera po primitku nakon akutnoga MU-a stoga može biti indikativno u smislu prognoze i ishoda MU-a. Povezanost akutnoga MU-a s D-dimerima zahtijeva daljnja istraživanja u kojima se treba uzeti u obzir višestruke čimbenike rizika i mehanizme MU-a.