Uvod
Parazit Toxoplasma gondii prvi su puta opisali Nicolle i Manceaux 1908. godine (1,2). Prvi slučaj okularne toksoplazmoze opisan je 1923. godine, ali veza s uzročnikom bolesti prihvaćena je tek 1939. godine (3,4). Životni ciklus parazita u cijelosti je otkriven 1970. godine kada su opisane njegove razvojne faze u tankome crijevu mačke (5).
Danas je toksoplazmotski retinokoroiditis jedan od najčešćih uzroka stražnjega uveitisa. Parazit ima do sada slabo objašnjenu, izrazitu sklonost za stražnji segment oka gdje u više od 50 % slučajeva zahvaća mrežnicu (6-8). Trećina svjetske populacije zaražena je tim parazitom, ali većina seropozitivnih osoba ne razvija simptomatsku bolest (9). Zemljopisni i socioekonomski čimbenici, dob, genetika, stanje imunološkoga sustava, genotip parazita kao i mnogi drugi čimbenici imaju značajan utjecaj na seroprevalenciju (10-12). Okularna toksoplazmoza najčešće se javlja u dobi od 20 do 40 godina. Prosječna je dob javljanja prve simptomatske infekcije 29,5 godina (7,13). Međutim, u 72 % tih pacijenata otkriveni su otprije prisutni retinokoroidalni ožiljci koji upućuju na prijašnje postojanje bolesti koja nije bila klinički manifestna.
Gubitak vidne oštrine i zamućenje vida glavne su manifestacije bolesti. Infekcija toksoplazmom klinički se najčešće očituje kao fokalni retinitis uz sekundarni koroiditis koji zahvaća unutarnje slojeve mrežnice, a prezentira se kao fokalna žuto-bijela lezija s okolnim edemom mrežnice i upalnom eksudacijom u staklasto tijelo. Lezija obično cijeli unutar razdoblja od jednoga do četiri mjeseca i postupno se zamjenjuje oštro ograničenim atrofičnim ožiljkom pigmentiranih rubova. Ožiljak je često manji od prvotno upalom zahvaćenoga područja mrežnice, a pigmentacija i atrofija žilnice ovise o stupnju oštećenja pigmentnoga epitela tijekom aktivne faze bolesti (6). Upalne promjene staklastoga tijela i žilnice ovise o veličini zahvaćenoga područja mrežnice. Velike lezije često uzrokuju vrlo ozbiljan vitritis koji se manifestira klasičnim znakom headlight in the fog (14). Vaskulitis mrežnice, kada je prisutan, najčešće zahvaća lokalni venski sustav, ali upalom mogu biti zahvaćene i arterije mrežnice (15). Upala može zahvatiti i papilu vidnoga živca, bilo kao posljedica izravnoga djelovanja uzročnika ili kao posljedica reaktivne upale (16-19). Bolesnici u kojih je zahvaćen vidni živac najčešće su osobe mlađe životne dobi u kojih, unatoč teškoj kliničkoj slici, dolazi do znatnoga oporavka vidne oštrine (18). Opisane su i brojne atipične manifestacije okularne toksoplazmoze koje u dijagnostičkome smislu predstavljaju izazov: pigmentna retinopatija, okluzija mrežničnih krvnih žila, serozna ablacija mrežnice, skleritis te prednji, intermedijarni, stražnji uveitis ili panuveitis, ali bez postojećeg retinitisa (20-27). Intraokularne upalne promjene bez postojećega retinitisa u pojedinaca mogu značiti početnu manifestaciju nedavno stečene infekcije parazitom T. gondii jer se tada u istome oku popratno razvija toksoplazmotski retinokoroiditis (26). Ponovno javljanje akutnoga retinokoroiditisa zabilježeno je u 79 % slučajeva (7). Najčešće se ponovno javlja u blizini prijašnje infekcije, uz rub pigmentnoga ožiljka (6). Trudnoća i operacija uklanjanja mrene povezane su s povećanim rizikom od ponovnoga javljanja bolesti (6,28).
U većini slučajeva dijagnoza okularne toksoplazmoze postavlja se na temelju kliničkoga nalaza. Serološke pretrage nemaju velik značaj u postavljanju dijagnoze. Unutar jednoga do dva tjedna od početka infekcije u serumu se pojavljuju IgG antitijela koja u njemu ostaju prisutna tijekom cijeloga života (29). S obzirom na to da je seropozitivnost rasprostranjena u većini zajednica, pozitivna prediktivna vrijednost IgG-a vrlo je niska te se njegova pozitivna vrijednost ne može interpretirati kao pokazatelj aktivne infekcije toksoplazmom. Međutim, porast titra specifičnih IgG antitijela kroz razdoblje od tri tjedna uzima se kao pokazatelj ponovljene bolesti (30). Visoki aviditet IgG antitijela ukazuje na ponovnu aktivaciju bolesti. Ako se retinitis razvije unutar jedne godine od pojave stečene sistemske infekcije, u serumu bi trebala biti vidljiva i IgM antitijela, ali promjenjiva stopa pada vrijednosti toga Ig izotipa ograničava korisnost ovoga testiranja. Jedina je iznimka trudnoća, kada majčin IgM može značiti akutnu infekciju kako majke tako i fetusa (31). Analiza uzorka intraokularnih tekućina (očne vodice i staklastoga tijela) metodom PCR (engl. Polymerase Chain Reaction) može biti iznimno važna u identificiranju T. gondii kao uzročnika, osobito u atipičnim slučajevima bolesti (32,33).
U imunokompetentnih pojedinaca toksoplazmotski retinokoroiditis spontano prolazi unutar dva mjeseca od početka bolesti. Klinička analiza rizika i koristi od primjene antimikrobnoga liječenja provodi se pojedinačno, od slučaja do slučaja. S obzirom na to da ne postoji lijek za koji se sa sigurnošću može reći da u ljudi liječi infekciju, cilj antimikrobnoga liječenja i dalje ostaje ograničavanje razmnožavanja parazita tijekom aktivnoga retinitisa (34). Unatoč navedenome, većina oftalmologa propisuje antimikrobne lijekove u liječenju imunokompetentnih bolesnika s aktivnom upalnom reakcijom koji imaju smanjenu vidnu oštrinu, leziju lokaliziranu unutar temporalnih arkada ili uz optički disk te zamućenje staklovine stupnja 1+ ili više (35).
Pojam klasična terapija ili trojna terapija odnosi se na peroralnu primjenu kombinacije piremetamina (2 mg/kg do najviše 50 mg dnevno tijekom prva dva dana, a nakon toga 1 mg/kg do najviše 25 mg dnevno podijeljeno u dvije dnevne doze tijekom idućih 4-6 tjedana), sulfadiazina (u početnoj dozi od 75 mg/kg, a nakon toga 50 mg/ kg svakih 12 sati tijekom 6 tjedana) i sistemskoga kortikosteroida (1 mg/kg za vrijeme trajanja aktivne upale i još dva tjedna nakon toga). Pirimetamin ima neželjena djelovanja od kojih se najozbiljnija odnose na krvotvorni sustav, uključujući leukopeniju i trombocitopeniju. Zbog toga se preporučuje tjedna kontrola kompletne krvne slike kroz čitavo razdoblje liječenja, a bolesnicima se dodatno propisuje folinična kiselina (5 mg svaki drugi dan peroralno). Kao alternativa klasičnoj terapiji može se propisati peroralna kombinacija trimetoprima i sulfometoksazola (160-800 mg dva puta dnevno). Ta kombinacija ima sličan učinak na uzročnika kao i kombinacija trimetoprima i sulfadiazina, a uz to je jeftina, dostupna i dobro podnošljiva (35). Kombinacija trimetoprim- sulfometoksazola sa sistemskim kortikosteroidima dobro je podnošljiva većini bolesnika, ali ne dovodi do smanjenja veličine lezije kao što to čini klasična
terapija (34). Klindamicin (300 mg četiri puta dnevno peroralno) često se dodaje takozvanoj trojnoj terapiji pa se ta kombinacija naziva i kvadriterapija. U 81 % slučajeva dolazi do dobroga odgovora unutar tri tjedna od početka primjene kvadriterapije, uključujući poboljšanje vidne oštrine i smirivanje upalne reakcije (36). Novije studije procjenjuju učinak primjene klindamicina (1 mg) i deksametazona (400 μcg) intravitrealnim injekcijama. Aplicira se jedna injekcija tjedno tijekom četiri tjedna, što se zasniva na činjenici da poluživot klindamicina intravitrealno iznosi šest dana. Ta kombinacija pokazala se osobito učinkovitom u slučajevima kada je lezija bila lokalizirana u makularnome području i u blizini vidnoga živca, kada je došlo do razvoja vrlo ozbiljnoga vitritisa te u slučajevima ponovljene bolesti (37-40).
U ovome je radu prikazana bolesnica u koje je primjenom trojne terapije došlo do relativno brzoga smirivanja retinokoroidalne upale i djelomičnoga oporavka vidne oštrine, sukladno stupnju oštećenja makule.
Prikaz slučaja
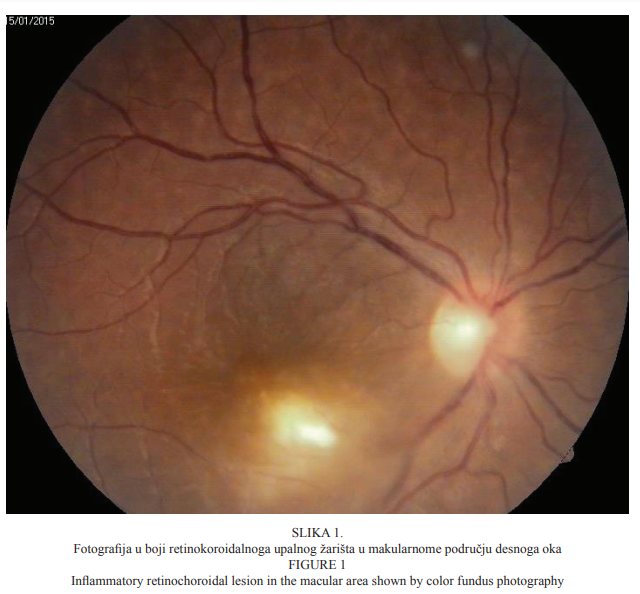
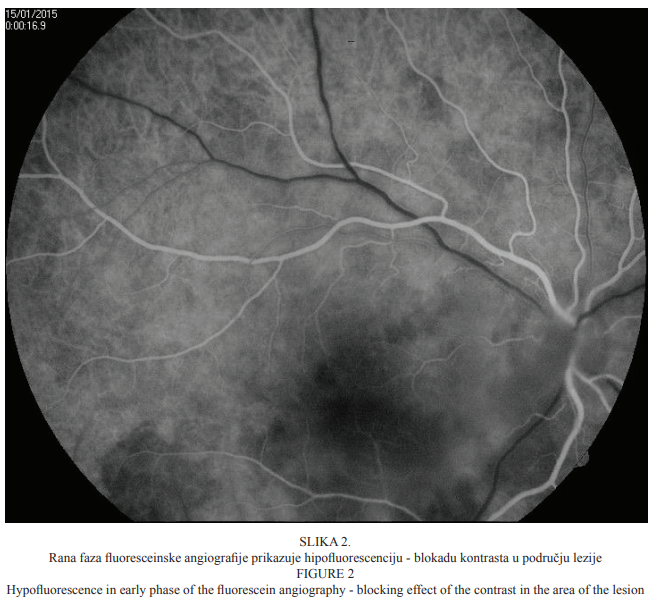
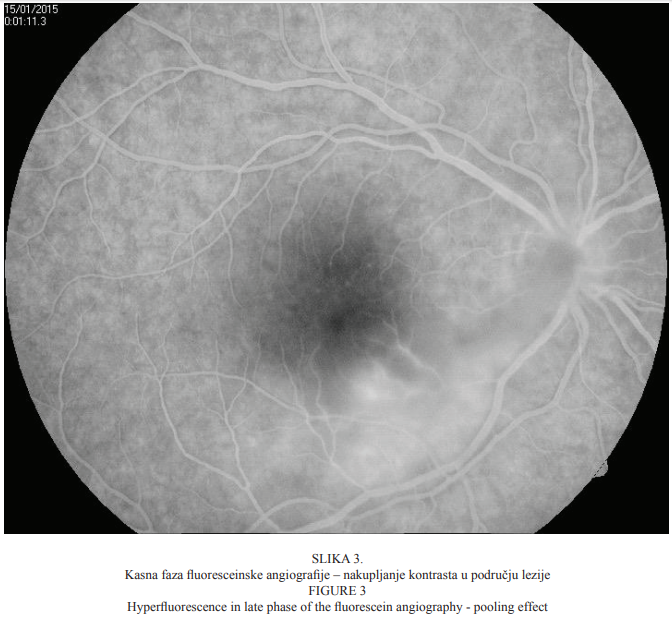
Bolesnica u dobi od 22 godine primljena je na kliničku obradu i liječenje zbog ispada u centru vidnoga polja i pada vidne oštrine desnoga oka koja se javila tri dana prije dolaska u našu ustanovu. Prilikom dolaska vidna je oštrina desnoga oka bila 0,03, a lijevoga 1,0 (tablice po Snellenu). Intraokularni tlak bio je uredan (aplanacijska tonometrija po Goldmannu). Pregledom prednjega segmenta oka biomikroskopom s procjepnom svjetiljkom nisu bile uočene patološke promjene. Pregledom stražnjega segmenta desnoga oka indirektnom biomikroskopijom uočene su upalne stanice u staklovini, peripapilarni edem, vijugave krvne žile mrežnice te retinokoroidalno upalno žarište u makuli (Slika 1.), koje je kliničkim izgledom upućivalo na toksoplazmotski retinokoroiditis. Fluoresceinska angiografija pokazala je promjene koje su ukazivale na postojanje aktivnoga retinokoroidalnog žarišta u makuli desnoga oka (Slike 2. i 3.).
Učinjena je cjelokupna dijagnostička obrada: kompletna i diferencijalna krvna slika, telerendgenogram srca i pluća, Mantoux test, HIV test te serološke pretrage na Toxoplazmu gondii i Toxocaru canii. U skladu s rezultatima kliničkoga pregleda započeto je liječenje peroralnom primjenom kombinacije pirimetamina, sulfadiazina i folinične kiseline, a tri dana poslije i prednizolona. Serološkim pretragama dokazane su povišene vrijednosti Toxoplasma gondii IgG antitijela, dok Toxoplasma gondii IgM antitijela nisu otkrivena, a svi su ostali rezultati dijagnostičkih pretraga bili u granicama normalnih vrijednosti.
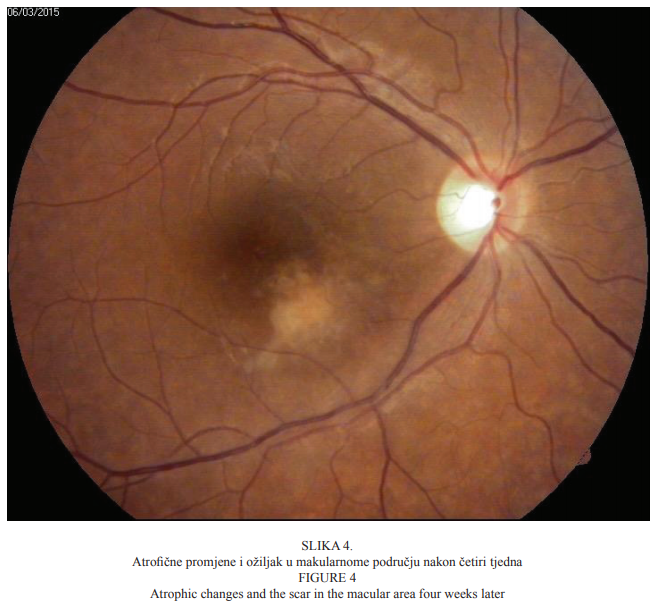
Već drugi dan nakon početka liječenja došlo je do smanjenja upalnih promjena stražnjega segmenta desnoga oka uz blago poboljšanje vidne oštrine. Nakon jednoga tjedna najbolja korigirana vidna oštrina iznosila je 0,1, a upalne promjene i dalje su bile u fazi smanjivanja. Četiri tjedna nakon početka liječenja najbolja korigirana vidna oštrina desnoga oka iznosila je 0,4. U staklovini više nisu bile prisutne upalne stanice, a područje makule u kojemu je bilo retinokoroidalno žarište atrofiralo je uz nastanak dobro ograničenoga ožiljka pigmentiranih rubova (Slika 4.). Nakon četiri mjeseca nastupilo je poboljšanje vidne oštrine desnoga oka te je najbolja korigirana vidna oštrina bila 0,6.
Liječenje u većini slučajeva nije potrebno, no ako je zahvaćeno makularno područje ili vidni živac, indicirano je liječenje antimikrobnim lijekovima. Postoje razne kombinacije lijekova, a peroralna primjena pirimetamina, sulfadiazina i folinične kiseline bila je naš izbor zbog učinkovitoga djelovanja na retinokoroidalno žarište, kao i zbog dokazanoga učinka na smanjenje veličine početne lezije. Zbog makularne lokalizacije upalnoga žarišta, trećega dana nakon početka antimikrobnoga liječenja, peroralno su primijenjeni i kortikosteroidi s ciljem smanjenja upalne reakcije i ubrzanja oporavka. U bolesnice je došlo do relativno brzoga smirivanja retinokoroidalne upale i djelomičnoga oporavka vidne oštrine.
Odlučili smo se za prikaz ovoga slučaja jer u liječenju toksoplazmotskoga retinokoroiditisa makularne lokalizacije, uz peroralnu primjenu pirimetamina, sulfadiazina i folinične kiseline, dodatna primjena kortikosteroida s ciljem smanjenja upalne reakcije i ubrzanja oporavka vida nalazi svoje mjesto u kliničkoj praksi.