Uvod i epidemiološki podaci
Prema literaturnim podacima, procjenjuje se da je 2010. godine u svijetu 20,9 milijuna muškaraca i 12,6 milijuna žena bolovalo od atrijalne fibrilacije (AF). Smatra se da će do 2030. godine Europska unija imati 14 do 17 milijuna bolesnika s AF-om, tj. da se svake godine dijagnosticira 120.000 do 250.000 novih bolesnika. Kako raste pojavnost čimbenika rizika tako se povećava i broj bolesnika s AF-om, već i u ranijoj životnoj dobi (1 –3). Tipični čimbenici rizika jesu: dob, hipertenzija, koronarna bolest, zatajivanje srca, valvularna bolest, adipozitet, diabetes mellitus te kronična bubrežna bolest (tablica 1.).
Bez obzira na razvijenost zemalja, prema statističkim podacima, incidencija i prevalencija AF-a s obzirom na dob, rjeđa je u žena, dok je rizik od smrti u žena jednak kao u muškaraca, pa i veći. Žene također imaju veći rizik od nastanka moždanog udara, posebice u starijoj životnoj dobi, čak i ako su dobro regulirane antikoagulacijskom terapijom. Rizik od krvarenja jednak je za oba spola (4, 5), a strategija prevencije nastanka AF-a prikazana je na tablici 2.
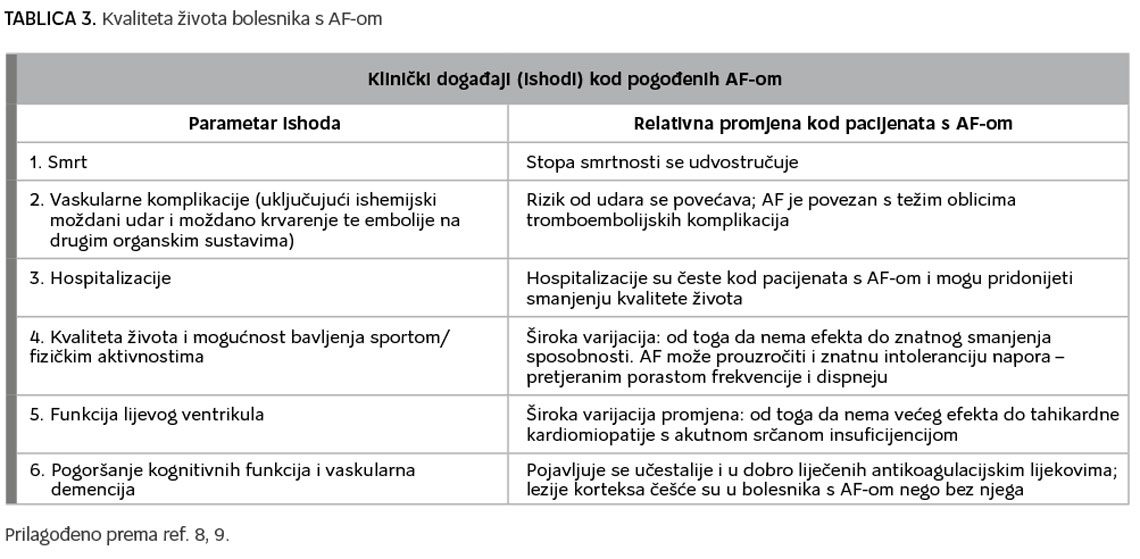
Atrijalna fibrilacija uzrok je znatnog morbiditeta i mortaliteta jer dugoročno utječe na remodeliranje miokarda i bitno povećava rizik od moždanog udara i dr. tromboembolijskih incidenata, a utječe i na kvalitetu života bolesnika, što je prikazano na tablici 3. (5 –7).
Mehanizam nastanka AF-a
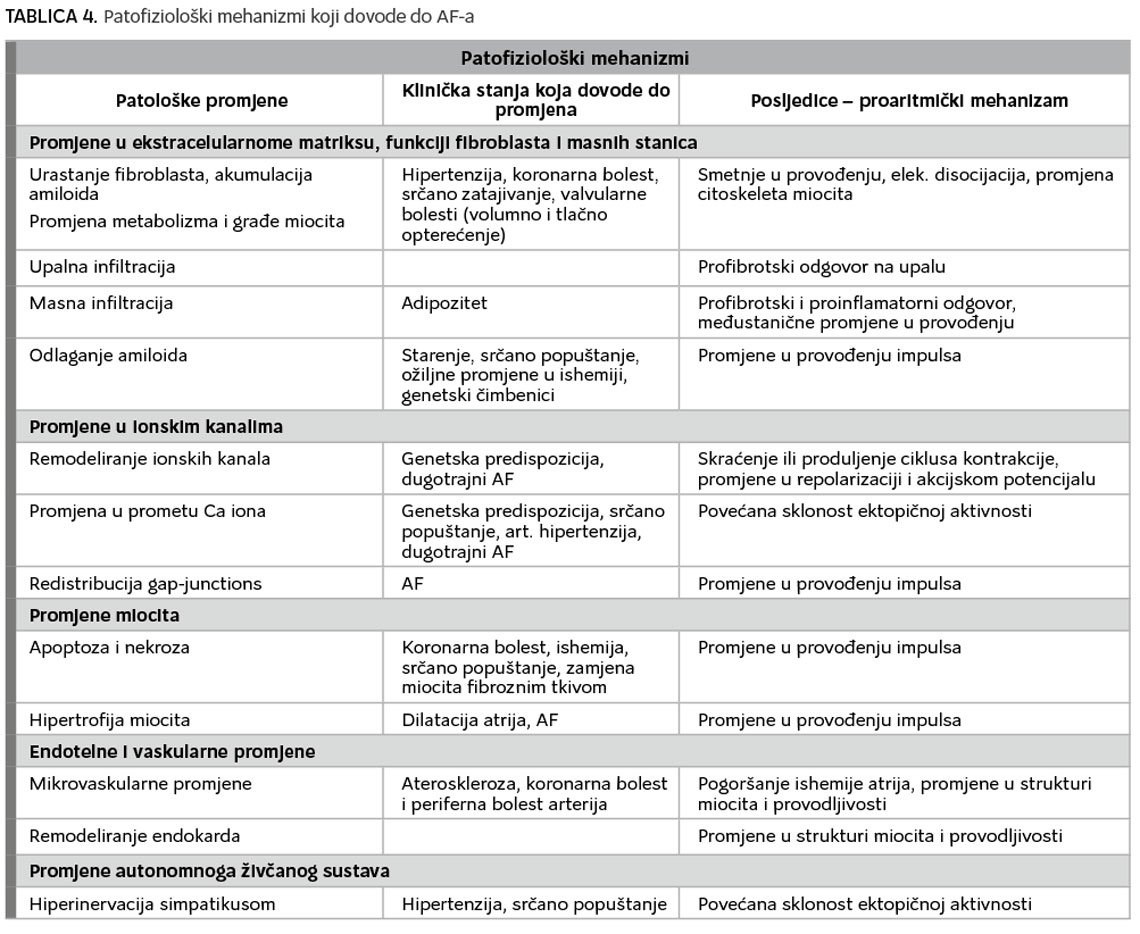
Patofiziološki i patomorfološki mehanizmi koji pridonose nastanka AF-a vrlo su kompleksni i mnogostruki (7). Radi preglednijeg i jednostavnijeg razumijevanja prikazani su natablici 4.
Prilagođeno prema ref. 8, 9.
Prilagođeno prema ref. 8, 9.
Klinički pristup bolesniku s atrijalnom fibrilacijom
S obzirom na pojavnost, AF se najčešće dijeli na:
Paroksizmalni AF – samolimitirajući, uglavnom prestaje spontano ili uz primjenu lijeka do 7 dana od nastanka. Epizode se javljaju varijabilnom učestalošću.
Perzistentni AF – epizoda AF-a koja ne prestaje spontano u roku od 7 dana te nalaže ili medikamentnu intervenciju ili elektrokardioverziju. Uglavnom se javlja kod bolesnika koji su već imali paroksizme AF-a (kao progresiju bolesti).
Dugotrajni (longstanding) AF – traje do 12 mjeseci, ali se kod nekih bolesnika ipak može donijeti odluka o ev. konverziji u sinusni ritam.
Permanentni AF – što je izraz za bolesnike s perzistentnim AF-om za koje se donosi odluka da trajno ostaju u AF-u te da se samo trajno kontrolira srčana frekvencija.
Postoji još i entitet Lone AF ili samostalni AF. Odnosi se na bolesnike u kojih se javlja paroksizmalni ili perzistentni AF, a bez strukturne bolesti srca (koja se utvrđuje klasičnim slikovnim metodama – iako su do sada identificirane razne autosomno dominantne i autosomno recesivne genetski uvjetovane strukturne promjene nekih proteina na membrani i u građi atrijalnih miocita, koje, međutim, nisu makroskopski vidljive), u bolesnika mlađih od 60 godina koji imaju izuzetno malen rizik od komplikacija (uključujući embolizaciju). Prema definiciji, takvi bolesnici imaju CHA2DS2-VASc-zbroj 0 (radi objašnjenja viditablicu 9. u tekstu) (8,9).
Radi odabira antikoagulacijske terapije važno je još da se AF dijeli i na „valvularni“ – što se primarno odnosi na bolesnike s umjetnim zalistcima ili s reumatskom valvularnom greškom (to je danas vrlo rijetko) i „nevalvularni“, tj. na bolesnike s AF-om i intaktnim zalistcima.
Ako su čimbenici rizika takvi da bitno mijenjaju strukturu miocita, tipični AF progredira od paroksizmalnog, preko perzistentnog do permanentnoga. Međutim, postoje stanja koja su reverzibilna i tada je AF sekundarna i prolazna pojava – primjerice nakon kardiokirurškog zahvata, kod mioperikarditisa, akutnog infarkta miokarda, plućne embolije ili hipertireoze. Tada je terapija primarno usmjerena na bolest u podlozi.
Posebni je problem supklinički AF, koji se često primjećuje u kardiološkoj praksi kod bolesnika koji imaju ugrađene pacemakere s mogućnošću memoriranja aritmijskih epizoda, a koje bolesnik ne osjeća. Većina tih bolesnika ima asimptomatski paroksizmalni AF, što je važno uočiti, jer kod njih valja trajno provoditi adekvatnu antikoagulacijsku terapiju (8,9).
Dijagnostički postupak u atrijalnoj fibrilaciji
U dijagnostičkom postupku osim anamneze, temeljitoga fizikalnog pregleda i EKG-a treba svakako učiniti i UZ srca te 24-satno dinamičko mjerenje EKG-a (holter). Ehokardiografski pregled izuzetno je važan zbog dvaju osnovnih razloga: prvi je utvrđivanje postojanja tromba u lijevom atriju (LA) (tj. aurikuli) i opasnosti od embolizacije, a drugi – utvrđivanje veličine kaviteta, posebice LA, sistoličke i dijastoličke funkcije miokarda, tlaka u plućnoj cirkulaciji, funkcije zalistaka, abnormalnosti u kontrakciji miokarda i ev. postojanja izljeva. 24-satno dinamičko mjerenje EKG-a (holter) važno je radi procjene kretanja frekvencije i u mirovanju i u aktivnostima tijekom dana te o tome ovisi odabir medikamentne terapije (8,9).
Liječenje bolesnika s atrijalnom fibrilacijom
U liječenju bolesnika s AF-om osnovni su ciljevi:
prevencija tromboembolizma
olakšavanje simptoma
optimalno liječenje pridruženih kardiovaskularnih bolesti (primjena ACEI, ARB, statina, stroga regulacija glikemije, hipertenzije i tjelesne težine)
kontrola srčane frekvencije (ovisno o bolesniku)
kontrola ritma – tj. održavanje sinusnog ritma (ovisno o bolesniku).
Kontrola srčane frekvencije
Podaci pokazuju da bolesnici kod kojih se želi postići kontrola ritma imaju učestalije hospitalizacije, više nuspojava vezanih uz lijekove i sličnu učestalost tromboembolijskih incidenata kao i skupina bolesnika kod kojih se provodi kontrola frekvencije srca (tablica 5.).
Važno je zapamtiti da oba pristupa nalažu trajnu antikoagulacijsku terapiju radi prevencije cerebrovaskularnog inzulta (10 –13).
Prema smjernicama natablici 5., prikazane su preporuke na osnovi kojih odabiremo bolesnike kojima kontroliramo ritam, a drugima srčanu frekvenciju.
Pacijenti s permanentnim AF-om, a bez teških simptoma zbog brzoga ventrikularnog odgovora, mogu se opuštenije liječiti kontrolom frekvencije (srčana frekvencija u mirovanju ˂ 110/min). Striktna kontrola frekvencije (u mirovanju ˂ 80/min i kontrolirano ubrzanje nakon umjerene vježbe) nužni su samo kod pacijenata koji ostaju sa simptomima.
Beta-blokatori su lijek izbora za bolesnike kojima treba adekvatna kontrola frekvencije u naporu, dok sedentarni bolesnici starije životne dobi mogu uspješno kontrolirati frekvenciju primjenom verapamila i/ili digoksina (8,9). Lijekovi i doze koje svakodnevno upotrebljavamo za kontrolu frekvencije navedeni su natablici 6., a razina dokaza preporuka za dugotrajnu kontrolu frekvencije natablici 7.
AF = atrijalna fibrilacija;
EHRA = Europska asocijacija za srčani ritam.
aKlasa preporuka;
bRazina dokaza
AF = atrijalna fibrilacija; otk./min = otkucaja u minuti;
LV = lijevi ventrikul;
NYHA = Njujorška asocijacija za srce.
aKlasa preporuka;
bRazina dokaza
Kontrola ritma – antiaritmijski lijekovi
Osnovni motiv za održavanje sinusnog ritma jest redukcija simptoma koje neki bolesnici s AF-om izuzetno teško podnose. Kardioverzija radi postignuća sinusnog ritma može se obaviti medikamentno i primjenom električne energije. Svi bolesnici prije toga moraju biti podvrgnuti adekvatnoj antikoagulacijskoj terapiji; ako se radi elektivno, tada najmanje 3 tjedna prije planiranog zahvata te najmanje 4 tjedna nakon njega prema smjernicama, a ako se radi o rekurentnim epizodama, onda trajno (8,9).
Vrlo često se teško postiže medikamentna konverzija u sinusni ritam. Lijek izbora je amiodaron, a kod strukturno zdravog srca i očuvane sistoličke funkcije LK može se primijeniti i propafenon. Jednaku učinkovitost ima i flekainid, ali nije registriran u Hrvatskoj. Stariji lijekovi kao kinidin, dizopiramid, prokainamid više se ne rabe. Dronedaron se rabi samo za održavanje sinusnog ritma, ali ne i za konverziju (8,9,14,15). Treba svakako naglasiti da je učinkovitost antiaritmika u održavanju sinusnog ritma umjerena, naime, terapija će uglavnom reducirati učestalost epizoda AF-a, ali ih neće eliminirati.
Bolesnici s rekurentnim AF-om koji dobro reagiraju na propafenon mogu ga nositi kao pill-in-the-pocket i uzeti prema potrebi. Nužno je da budu trajno liječeni antikoagulacijskim lijekovima.
Ako se učinak ne postigne jednim lijekom, tada se može pokušati s drugim antiaritmikom. Svaki od lijekova ima i jake nuspojave pa takvi bolesnici trebaju biti u kontaktu sa svojim obiteljskim liječnikom i kardiologom. Osnovno pitanje pri propisivanju terapije jest sigurnost bolesnika.
AF = atrijalna fibrilacija; AV = atrioventrikularan; LoE = nivo dokaza; NYHA = engl. New York Heart Association,
aKlasa preporuka;
bRazina dokaza
Kod pacijenata bez minimalne ili s minimalnom strukturnom bolešću srca lijekovi se biraju primarno prema sigurnosnom profilu. Pacijentima sa strukturnom bolešću srca izbor lijeka određen je glavnom kardiološkom patologijom. Treba naglasiti da dronedaron nije preporučljiv za pacijente sa srčanom slabošću i sa smanjenom funkcijom LV-a te za pacijente sa srčanom slabošću ili sa smanjenom funkcijom LV-a (8,9,14,15).
Ablacijske metode liječenja (ablacija AV-čvora, radiofrekventna ablacija plućnih vena i krioablacija plućnih vena)
Ablacija atrioventrikularnog (AV) čvora omogućuje visokoučinkovitu kontrolu ventrikularne frekvencije u bolesnika s AF-om. Ablacija AV-čvora palijativni je i ireverzibilni postupak te ga je samim tim razborito odabrati samo u bolesnika kod kojih nije indicirana kontrola ritma, a farmakološka terapija srčane frekvencije, uključujući i kombinaciju nekoliko antiaritmika, ostaje bez učinka. Stoga je ablacija AV-čvora vrijedan, ali rijetko indiciran postupak kojim se postiže totalni AV-blok s posljedičnom nužnom implantacijom elektrostimulatora.
Posljednjih godina razvile su se metode kateterske ablacije koje ciljaju primarno na supstrat i/ili na početne okidače AF-a. Najbolji rezultati (kontrola ritma tijekom najmanje godine dana i do 90%) mogu se očekivati kod mlađih bolesnika (< 65 godina), bez uznapredovale strukturne bolesti srca (uključujući hipertenziju), s blago dilatiranim LA, kraćom anamnezom recidivirajuće paroksizmalne i simptomatske fibrilacije atrija. Kod prikladnih kandidata postupak se odnosi u prvom redu na izolaciju ušća plućnih vena, čime se djeluje na osnovni patofiziološki mehanizam okidačâ koji su ovdje anatomski locirani (16 –19).
Kod bolesnika s duljom anamnezom, permanentnim ili perzistentnim AF-om, velikim LA, uznapredovalom strukturnom bolešću srca i starije životne dobi patofiziološki dominantnu ulogu ima promjena strukture LA pa su rezultati očekivano lošiji (uspješna kontrola ritma u 50 – 60% slučajeva). Postupak se ovdje mora proširiti na čitav LA (dijelom imitirajući klasični kirurški postupak tzv. Maze-operacije, tj. stvaranja odjeljaka u LA), a recidivi s potrebom reablacije značajno su češći (i do 40%). Ove godine objavljeni su i rezultati velike studije koja je komparirala dvije metode ablacije žarišta iz plućnih vena: radiofrekventne ablacije i krioablacije (FIRE AND ICE trial) i obje su postignule slične i usporedive učinke što se tiče sigurnosti i učinkovitosti, a oba se postupka izvode rutinski i u našoj zemlji (20).
Nužnost trajne antikoagulacijske terapije i procjena rizika od moždanog udara i/ili krvarenja
Bolesnici s AF-om imaju znatno povećan rizik od moždanog udara pa je kod njih nužna antikoagulacijska terapija koja ga bitno reducira. Smjernice snažno preporučuju da se praksa okrene prema pronalaženju pacijenata s AF-om i „zaista malim rizikom“ (bez obzira na spol) ili CHA2DS2-VASc-zbrojem = 0, koji ne trebaju antitrombocitnu terapiju, a ne prema fokusiranju „na visokorizične pacijente“. CHA2DS2-VASc-bodovanje (viditablicu 9.) bolje je u identifikaciji „zaista niskorizičnih pacijenata“ s AF-om u kojih se mogu razviti moždani udar ili tromboembolija.
Pacijentima s AF-om koji imaju ≥ 1 rizičnog faktora za moždani udar preporučuje se efikasna terapija za prevenciju moždanog udara, koju bazično čine oralni antikoagulacijski lijekovi (OAC) bilo s terapijom dobro doziranim antagonistima vitamina K (varfarin) (INR 2 – 3, sa što većim postotkom vremena u terapijskom opsegu, npr. najmanje 70%) ili novim oralnim antikoagulacijskim lijekovima (NOACs).
Treba naglasiti da je efikasnost prevencije moždanog udara acetilsalicilnom kiselinom (ACSK) izuzetno slaba, potencijalno štetna, s obzirom na to da postoji rizik od velikog krvarenja (i intrakranijalnoga) koji se znatno ne razlikuje od onoga zbog OAC (posebice kod starijih ili onih koji uzimaju NOAC). Uporaba antiagregacijske terapije (kombinacije: ASK + klopidogrel) za prevenciju moždanog udara kod prisutnosti AF-a treba biti ograničena na bolesnike koji odbijaju bilo koji oblik OAC (21 –24).
*raniji infarkt miokarda, periferna bolest arterija, aortalni plak. Moždani udar, TIA ili sistematska embolizacija i dob ≥ 75 godina smatraju se jakim rizičnim faktorima, a ostali se opisuju kao klinički relevantni slabi rizični faktori.
„Hipertenzija“ se definira kao nekontrolirani krvni tlak, npr. sistolički > 160 mmHg. „Nenormalna funkcija bubrega“ definira se kao prisutnost kronične dijalize ili transplantacije bubrega ili serumskog kreatinina ≥ 200 μmol/L. „Nenormalna funkcija jetre“ definira se kao kronična bolest jetre (npr. ciroza) ili biokemijski dokaz o znatnom poremećaju jetrenih enzima (npr. bilirubin 2× povišen iznad normalne granice, zajedno s AST/ALT/ALP 3× iznad normalne granice itd.). „Krvarenje“ se odnosi na raniju anamnezu krvarenja i/ili predispoziciju za krvarenje, npr. trombocitopenija, anemija itd. „Labilan INR“ – misli se na nestabilan, viši ili niži INR u odnosu prema terapijskom opsegu (npr. < 60%). „Lijekovi ili alkohol“ – misli se na istodobnu upotrebu lijekova kao što su antiagregacijski lijekovi, nesteroidni antiinflamatorni lijekovi itd. ili zloupotreba alkohola.
HAS-BLED-bodovanje (tablica 10.) omogućava kvalitetnu procjenu rizika od krvarenja i, još važnije, usmjerava liječnika na korekciju čimbenika koji su potencijalno ispravljivi. Kod pacijenata s HAS-BLED-zbrojem ≥ 3 preporučuju se oprez i redoviti pregledi, kao i napor da se isprave potencijalno ispravljivi rizični čimbenici za krvarenje. Visoki HAS-BLED-zbroj per se ne bi se trebao rabiti da se pacijenti isključe iz terapije OAC-om.
Potreba za tromboprofilaksom treba biti dio svake evaluacije bolesnika, bez obzira na tip AF-a (je li paroksizmalan, perzistentan ili permanentan) (8,9).
Preporučeni lijekovi
Varfarin kao antagonist vitamina K najstariji je i najčešće upotrebljavan antikoagulacijski lijek. Jedina mu je mana potreba za individualizacijom doze i redovitom kontrolom INR-a kako bi se postigle terapijske vrijednosti (INR 2 – 3).
Novi antikoagulacijski lijekovi (NOAK)
Rivaroksaban, dabigatran i apiksaban lijekovi su koje imamo u Hrvatskoj registrirane za prevenciju tromboembolijskih incidenata u bolesnika s AF-om. Nove Europske smjernice preferiraju NOAK u odnosu prema antagonistima vitamina K u većine bolesnika s nevalvularnom fibrilacijom atrija i strogo pridržavanje odobrenih indikacija. Svi NOAK imaju sličnu preporuku. Nema izravnih usporedaba i stoga nema dovoljno dokaza na temelju kojih bi se jedan NOAK preferirao u odnosu prema drugomu. Prije započinjanja terapije treba upotrijebiti bodovni sustav HAS-BLED za identifikaciju rizika od krvarenja. U bolesnika s HAS-BLED ≥ 3 potrebni su oprez i redovita provjera stanja, a valja i pokušati ispraviti potencijalno reverzibilne čimbenike rizika od krvarenja (npr. nekontrolirana hipertenzija, istodobna uporaba nesteroidnih protuupalnih lijekova, promjenjive vrijednosti INR-a, konzumiranje alkohola itd.) (8,9,23,24).
Ostala terapija
Usporedna terapija kako bi se spriječilo remodeliranje miokarda povezano s hipertenzijom, srčanom slabošću ili upalom može usporiti razvoj novog AF-a (primarna prevencija) ili, ako se već pojavio, njegovu učestalost vraćanja ili progresiju u permanentni AF (sekundarna prevencija). Usporednom terapijom AF-a smatra se liječenje inhibitorima konvertaze angiotenzina (ACEI), blokatorima angiotenzinskih receptora (ARB), antagonistima aldosterona, statinima i omega-3 polinezasićenim masnim kiselinama (PUFA).
Usprkos mnoštvu podataka o antiaritmogenom potencijalu ovih lijekova na životinjskim modelima, klinički podaci ostaju za neke lijekove kontroverzni. Najviše dokaza skupljeno je za primarnu prevenciju AF-a u srčanom popuštanju s ACEI i ARB te za postoperativni AF sa statinima. Međutim, ACEI, ARB ili statini sami za sebe nisu dovoljno efikasni za sekundarnu prevenciju kod pacijenata bez bolesti srca ili s manjom osnovnom bolešću (25,26). Trenutačno, nema bitnih dokaza za bilo kakve preporuke o uporabi PUFA-e u primarnoj ili sekundarnoj prevenciji AF-a.