UVOD
INTRODUCTION
Poljski jasen (Fraxinus angustifolia Vahl), gospodarski i ekološki vrlo značajna vrsta nizinskih šuma Hrvatske, posljednjih nekoliko godina pokazuje sve izraženije simptome odumiranja. Prema procjeni oštećenosti krošanja koja se u Hrvatskoj provodi svake godine u sklopu međunarodnog programa ICP Forests, udio značajno osutih stabala poljskog jasena (osutost veća od 25 %) je u 2014. godini narastao s 23,61 na 49,09 % u odnosu na prethodnu godinu, te se u 2015. nastavio povećavati do 62,50 % (Potočić i sur. 2016). Dosadašnja istraživanja mogućih uzroka odumiranja bila su usmjerena na nadzemne dijelove stabala te su potvrdila prisutnost patogene gljive Hymenoscyphus fraxineus Baral, Queloz & Hosoyana više različitih lokacija na stablima narušenog zdravstvenog stanja u Hrvatskoj (Diminić 2015,Milotić i sur. 2016), a zaraza poljskog jasena navedenim patogenom potvrđena je i u Češkoj (Jankovsky i Holdenrieder 2009), Austriji (Kirisits i sur. 2010) te Sloveniji (Hauptman i sur. 2012).
Kako je odumiranje šumskih sastojina posljedica kumulativnog i sinergijskog djelovanja više različitih abiotskih i biotskih čimbenika, istraživanja koja se provode s ciljem pronalaženja uzroka su sveobuhvatna, te osim pregleda nadzemnog dijela oboljelih stabala često uključuju i pretraživanje podzemnog dijela, to jest, korijenovog sustava i tla. Pritom se prisutnost gljivama sličnih organizama, s naglaskom na patogene vrste roda Phytophthora, smatra važnim biotskim čimbenikom odgovornim za smrtnost stabala (Jankowiak i sur. 2014).
Gljivama slični organizmi (Oomycetes) predstavljaju raznoliku skupinu eukariota koji su dugo vremena smatrani gljivama, a uključuju saprotrofe i patogene biljaka i životinja te ostale različite mikroorganizme (Margulis i Schwartz 2000). U odumiranju nekih od najvažnijih vrsta šumskog drveća u Europi sudjeluju gljivama slični organizmi roda Phytophthora (Jung i sur. 2013), dok su vrste roda Pythium poznate kao kozmopolitske vrste sveprisutne u tlu, od kojih su nekolicina potvrđene kao biljni patogeni koji mogu uzrokovati polijeganje ponika, ali i trulež plodova, sjemena, korijena i debla šumskih vrsta drveća ponajprije u rasadnicima (Campbell i sur. 1972,Jankowiak i sur. 2015). Vrste roda Pythium koje su pripadale kladi K (Lévesque i de Cock 2004) u novije vrijeme su zbog značajki koje dijele s vrstama roda Phytophthora svrstane u novi rod Phytopythium (Bala i sur. 2010,de Cock i sur. 2015), a autori navode kako i u ostalim kladama (A-J) može doći do sličnih promjena, iako preporučuju korištenje dosadašnje podjele dok se ne nađu odgovarajući filogenetski biljezi (de Cock i sur. 2015).
U Europi je do sada provedeno nekoliko istraživanja usmjerenih na identifikaciju gljivama sličnih organizama u tlu šumskih sastojina te njihovu potencijalnu ulogu u procesu odumiranja. U sastojinama hrasta lužnjaka (Quercus robur L.) različitog zdravstvenog stanja je u Njemačkoj (Jung i sur. 2000), Italiji (Vettraino i sur. 2002), Švedskoj (Jönsson i sur. 2003), Austriji (Balcì i Halmschlager 2003a), Turskoj (Balcì i Halmschlager 2003b) i Poljskoj (Jankowiak i sur. 2014) utvrđeno kako postoji određena povezanost pronađenih vrsta roda Phytophthora u tlu i zdravstvenog statusa stabala. Slična istraživanja provedena u sastojinama sa simptomima odumiranja u Poljskoj i Danskoj na običnom jasenu (Fraxinus excelsior L.) (Orlikowski i sur. 2011) te u Turskoj na poljskom jasenu (Akilli i sur. 2013) potvrdila su prisutnost vrsta roda Phytophthora u tlu, te uputila na njihovo sudjelovanje u procesu odumiranja stabala.
Dio do sada provedenih istraživanja usmjerenih ponajprije na identifikaciju vrsta roda Phytophthora,također opisuje prisutnost vrsta rodova Pythium i Phytopythium u šumskim tlima, ali bez potvrde njihovog utjecaja na zdravstveno stanje stabala (Jung i sur. 2000,Jönsson i sur. 2003,Balcì i Halmschlager 2003a,Balcì i Halmschlager 2003b,Jankowiak i sur. 2015). Osim u tlu, vrste rodova Phytophthora i Pythium identificirane su u riječnim tokovima u blizini zaraženih šumskih područja u Poljskoj i Ukrajini (Matsiakh i sur. 2016).
U Hrvatskoj su preliminarna testiranja pomoću terenskih dijagnostičkih testova (eng. Pocket diagnostic test, Abingdon Health Ltd., UK) za dokazivanje prisutnosti vrsta roda Phytophthora u biljnom tkivu pokazala pozitivne rezultate na uzorcima tla u odumirućim sastojinama poljskog jasena na području Posavine (Hegol 2016). Kako su navedeni rezultati općenitog karaktera te ne pružaju dodatne informacije o samim vrstama, svrha ovog istraživanja bila je utvrditi prisutnost gljivama sličnih organizama u tlu sastojina poljskog jasena, koje pokazuju simptome odumiranja metodama koje uključuju izolaciju i identifikaciju vrsta, s ciljem da se potvrdi ili odbaci hipoteza kako patogene vrste iz roda Phytophthora imaju potencijalnu ulogu u odumiranju stabala. Osim toga, namjera je bila dati doprinos poznavanju bioraznolikosti gljivama sličnih organizama u tlu šumskih ekosustava Republike Hrvatske, o čemu do sada postoji vrlo malen broj zapisa.
MATERIJALI I METODE
MATERIALS AND METHODS
Uzorkovanje tla na terenu
Soil sampling in the field
Uzorkovanja tla obavljena su tijekom listopada i studenog 2016. godine na četiri različite lokacije u sastojinama poljskog jasena u kojima postoji problem odumiranja. Lokacije uzorkovanja obuhvatile su GJ Josip Kozarac na području šumarije Lipovljani, GJ Črnovščak na području šumarije Dugo Selo te GJ Trstika na području šumarije Novska. Tlo se sakupljalo oko stabala svrstanih u tri kategorije zdravstvenog stanja procijenjenog na temelju stupnja osutosti krošnje određenog prema teoretskom referentnom stablu. U zdrava stabla su svrstana ona s osutošću krošnje manjom ili jednakom 25 %, u stabla narušenog zdravstvenog stanja ona s osutošću od 26 do 60 %, dok su stabla osutosti od 61 do 99 % kategorizirana kao odumiruća (tablica 1). Odumrla stabla se nisu uzimala u obzir. U svakoj je gospodarskoj jedinici uzorkovano tlo oko 10 stabala iskapanjem po tri monolita tla zajedno sa sitnim korijenjem približnih dimenzija 25 x 25 x 25 cm (bez listinca i humusa) na tri različite točke na rubu projekcije krošnje, odnosno na udaljenosti 0,5 – 1 m od debla, ovisno o promjeru krošnje svakog istraživanog stabla. Tri su uzorka homogenizirana u jedan, od kojeg se za daljnje laboratorijske analize uzimao poduzorak volumena približno dvije litre (Jankowiak i sur. 2014).
Legenda: Zdravstvena kategorija: 1-zdrava stabla osutosti krošnje ≤ 25 %, 2-stabla narušenog zdravstvenog stanja osutosti krošnje 26-60 %, 3-odumiruća stabla osutosti krošnje 61-99 %
Legend: Health category: 1-healthy trees with crown defoliation ≤ 25%, 2-trees having impaired health status with crown defoliation of 26-60%, 3-declining trees with crown defoliation of 61-99%
Laboratorijska analiza uzoraka - metoda potapanja tla
Laboratory analysis of samples – soil flooding method
Za laboratorijsku obradu uzoraka tla korištena je prilagođena metoda premaThemann i Werres (1999). U razdoblju od 24 h od vremena sakupljanja, po 250 ml svakog uzorka tla ravnomjerno je raspoređeno u plastične posude dimenzija 23,5 x 15 x 5 cm te potopljeno ultračistom vodom (0,055 μS/cm) volumena 500 ml, tako da je površina vode bila 1 do 2 cm iznad površine tla. Ovako pripremljeni uzorci ostavljali su se tri dana na sobnoj temperaturi (18-22 °C) u poklopljenim posudama (Vettraino i sur. 1999), nakon čega se na površinu vode postavljalo 3 do 5 razvijenih i svježe ubranih listova vrsta Rhododendron catawbiense Michx. i Prunus laurocerasus L. Listovi su prethodno oprani vodom iz slavine, uz lagano četkanje kako bi se uklonile veće nečistoće te zatim kratko isprani u sterilnoj vodi (sterilizacija u autoklavu na 121 °C, 20 min) i ostavljeni da se u potpunosti osuše unutar laminarnog kabineta za rad u atmosferi čistog zraka. Posude s postavljenim listovima su se lagano zaklopljene ostavljale na sobnoj temperaturi i prirodnom režimu svjetlosti 2 do 8 dana, odnosno do pojave prvih simptoma infekcije gljivama sličnih organizama na lišću (kloroza i nekroza).
Izolacija gljivama sličnih organizama iz simptomatičnih listova
Isolation of fungal-like organisms from symptomatic leaves
Za izolacije gljivama sličnih organizama iz simptomatičnih listova pripremljene su hranjive podloge 10 % CJA (Carrot Juice Agar,sok mrkve iz biološkog uzgoja, dmBIO Karottensaft) te 10 % VJA (Vegetable Juice Agar, povrtni sok iz biološkog uzgoja, Biotta Breuss). Za pripremu 1 litre navedenih podloga je u 100 ml soka dodan 1 g kalcijevog karbonata (CaCO3) uz stalno miješanje na 150 °C u trajanju od 20 minuta, te zatim 900 ml destilirane vode i 15 g agar-agara, uz stalno miješanje na 250 °C u trajanju od približno 30 minuta (Jeffers 2007). Prije izlijevanja u sterilne Petrijeve zdjelice, hranjive su podloge sterilizirane u autoklavu 20 minuta na 121 °C, te je u njih dodana vodena otopina antibiotika (1 % streptomicin sulfat, 20 ml/l) nakon što su ohlađene na približno 55 °C. Za rast čistih kultura su se koristile hranjive podloge PDA (Potato Dextrose Agar, Difco) i MEA (Malt Extract Agar, Difco) pripremljene prema uputama proizvođača.
Listovi s vidljivim simptomima infekcije oprani su vodom iz slavine, zatim površinski sterilizirani uranjanjem u 0,04 % otopinu NaOCl u trajanju dvije minute, te tri puta isprani u sterilnoj vodi, nakon čega su ostavljeni da se u potpunosti osuše unutar laminarnog kabineta za rad u atmosferi čistog zraka (Themann i Werres 1999). Komadići listova veličine približno 3 x 3 mm uzimani su s ruba klorotičnog i/ili nekrotičnog tkiva te uronjeni u hranjive podloge, tako da su čitavom površinom bili u dodiru s antibiotikom, čime se nastojao spriječiti razvoj bakterija. Ovako pripremljene Petrijeve zdjelice inkubirane su u tami na 21 °C. Rast micelija praćen je svakodnevno tri tjedna uz redovito presađivanje, kako bi se dobile čiste kulture.
Indukcija sporangija
Induction of sporangia
Mikroskopskim pregledom dobivenih čistih kultura micelija utvrdilo se kako ne postoje morfološke značajke koje bi pomogle u identifikaciji, stoga je inducirana tvorba sporangija korištenjem tri različite nesterilne otopine tla. Kockice hranjivih podloga zajedno s pripadajućim micelijem površine približno 0,5 cm2 izrezane su s ruba kultura starih 4 do 7 dana te u sterilnim Petrijevim zdjelicama promjera 9 cm potopljene nesterilnom otopinom tla volumena 25 ml. Zatvorene Petrijeve zdjelice ostavljene su 24 do 48 sati na sobnoj temperaturi i prirodnom režimu svjetlosti, nakon čega se micelij promatrao i fotografirao pod svjetlosnim mikroskopom (Olympus BX41 s ugrađenom digitalnom kamerom Olympus DP20). Iako neki autori (Drenth i Sendall 2001) navode mogućnost korištenja destilirane vode u tu svrhu, u ranijim se istraživanjima za uzorke s istih lokacija nije pokazala učinkovitom (Hegol 2016), stoga su korištene nesterilne otopine tla koncentracija 1 %, 1,5 % te 5 %. Prve dvije otopine dobivene su miješanjem odgovarajuće mase tla (10, odnosno 15 g) u 1 L ultračiste vode (0,055 μS/cm) na magnetskoj miješalici u trajanju od 4 sata, te je gornji vodeni sloj nakon što se tlo istaložilo filtriran gravitacijskom metodom kroz filter papir (Grade 388, Boeco Germany) (Drenth i Sendall 2001,Jeffers i Aldwinckle 1987). Za treću je otopinu 50 g tla potopljeno 1 litrom ultra čiste vode te ostavljeno da odstoji 48 sati, nakon čega je vodeni sloj bez taloga filtriran gravitacijskom metodom kroz filter papir (Grade 388, Boeco Germany) (Jung i sur. 1996). Otopine su čuvane u hladnjaku u tami na 4 °C.
Identifikacija vrsta molekularnim metodama
Species identification using molecular methods
Za molekularne analize odabrana su po dva izolata morfoloških značajki karakterističnih za gljivama slične organizme sa svake istraživane lokacije. Izolacija DNA iz micelija vršena je prilagođenom metodom premaAllemann i sur. (1999) u Molekularno-biološkom laboratoriju Šumarskog fakulteta Sveučilišta u Zagrebu. Izolati su uzgojeni na MEA hranjivim podlogama na sterilnim celofanskim diskovima (Bio-Rad, Cellophane Membrane Backing) u tami na 21 °C. Za izolaciju DNA je odvagano približno 50 mg ovako uzgojenih micelija starih 7 dana za svaki odabrani izolat. Nakon mehaničke homogenizacije tkiva u tekućem dušiku (N2) u mikroepruvetama, uzorcima je dodano 800 μl pufera za lizu (20 mM Tris, 200 mM NaCl, 2 mM EDTA, 10 % SDS, pH 8) i jednak volumen smjese fenol:kloroform:izoamilni alkohol u omjeru 25:24:1. Nakon centrifugiranja (Eppendorf AG 5804 R laboratorijska centrifuga) 10 minuta na 5000xg, vodena faza je otpipetirana u novu mikroepruvetu u koju je dodan jednak volumen otopine kloform:izoamilnog alkohola omjera 24:1. Nakon ponovnog centrifugiranja 10 minuta na 5000xg, vodena faza je otpipetirana u novu mikroepruvetu u koju je dodan jednak volumen izopropanola. Nakon centrifugiranja 20 minuta na 15000xg i 4 °C je supernatant dekantiran, a dobiveni talog DNA ispran s 500 μl ledeno-hladnog 70 % etanola. Mikroepruvete su podvrgnute centrifugiranju 3 minute na 15000xg i 4 °C, nakon čega je etanol dekantiran, a talog DNA osušen približno 10 minuta na zraku te naposljetku otopljen u 50 μl TE pufera (10 mM Tris, 1 mM EDTA).
Daljnja analiza dobivenih uzoraka DNA izvršena je u laboratoriju tvrtke InovaGen d.o.o. (Zagreb, Hrvatska), a obuhvaćala je lančanu reakciju polimerazom (PCR), kako bi se umnožila ciljana ITS regija te određivanje slijeda nukleotida (sekvence) navedene regije radi identifikacije vrsta. Pritom je za umnažanje ciljane sekvence korišten par početnica ITS4 (5'TCCTCCGCTTATTGATATGC3') i ITS6 (5'GAAGGTGAAGTCGTAACAAGG3') (White i sur. 1990,Cooke i sur. 2000) te protokol premaGrünwald i sur. (2011). Izolati su identificirani usporedbom dobivenih sekvenci s postojećima u bazi gena NCBI GenBank primjenom algoritma BLAST (Basic Local Alignment Search Tool).
REZULTATI, RESULTS
Uspješnost izolacije gljivama sličnih organizama iz tla
Na listovima postavljenima na uzorke tla sakupljene u Dugom Selu, prvi su se simptomi razvili nakon 5 do 6 dana na svim uzorcima. Simptomi su bili vidljivi u obliku okruglih i nepravilnih kloroza i smeđih i crnih nekroza na sredini i rubovima plojki te onih koje su se širile od vrha ili baze uz središnju žilu prema sredini plojke (slika 1). Miceliji karakteristični za gljivama slične organizme primijećeni su na svim uzorcima osim na listovima uzoraka broj 18 i 27 koji su sakupljeni oko stabala prve i druge zdravstvene kategorije. Kod svih osam dobivenih čistih kultura karakterističnih micelija uspješno je inducirana tvorba sporangija.
Listovi postavljeni na uzorcima tla iz Lipovljana počeli su pokazivati prve simptome nakon 4 do 5 dana na svim uzorcima, osim kod tla sakupljenog oko stabla broj 51 koje je na terenu procijenjeno kao stablo narušenog zdravstvenog stanja. Simptomi su bili jednaki onima zabilježenim na listovima uzoraka iz Dugog Sela. Miceliji s vegetativnim morfološkim značajkama karakterističnim za gljivama slične organizme razvili su se na osam uzoraka listova, odnosno nisu razvijeni kod listova uzorka broj 56 (stablo narušenog zdrav. stanja). Tvorba sporangija uspješno je inducirana na svih osam karakterističnih micelija.
Prvi su se simptomi na listovima postavljenim na uzorcima tla iz Novske pojavili šest dana nakon potapanja tla, osim kod uzorka 77, gdje su se pojavili nakon 10 dana. Razvijeni su kod svih uzoraka te su bili jednaki onima primijećenim na listovima uzoraka tla s prethodne dvije lokacije. Rast micelija morfološki karakterističnog za gljivama slične organizme utvrđen je kod listova gotovo svih uzoraka, s iznimkom uzoraka broj 78 (odumiruće stablo) i 89 (stablo narušenog zdrav. stanja). Od ukupno osam dobivenih čistih kultura karakterističnih micelija, tvorba sporangija je uspješno inducirana kod njih sedam. Kod izolata vezanog uz uzorak broj 86 (zdravo stablo) nakon potapanja micelija nesterilnom otopinom tla nisu primijećene nikakve generativne tvorbe koje bi upućivale na gljivama sličan organizam.
Identifikacija vrsta
Za molekularne analize odabrano je ukupno šest morfološki karakterističnih izolata, po dva sa svake istraživane lokacije. Od toga je pet izolata uspješno razvilo sporangije (slika 2), dok je izolat uzorka broj 86 razvio micelij morfološki karakterističan za gljivama slične organizme, ali bez generativnih tvorbi, zbog čega je posebno odabran za identifikaciju molekularnim metodama.
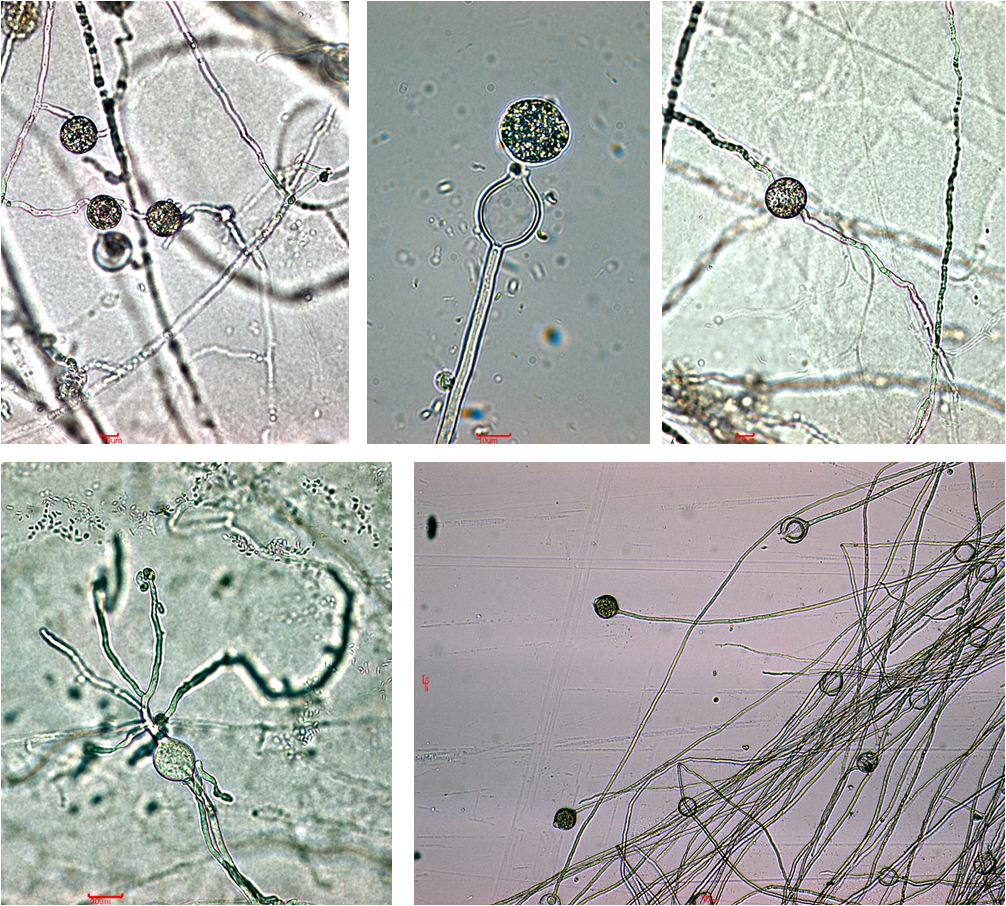
DNA zadovoljavajućih prinosa i čistoće izolirana je iz micelija svih odabranih izolata. Iako se odabrani par početnica pokazao odgovarajućim za umnažanje ciljane regije lančanom reakcijom polimerazom, jer su za sve uzorke izolirane DNA dobiveni specifični produkti veličine približno 800-900 bp, sekvenciranje početnicom ITS6 nije rezultiralo dovoljno kvalitetnim sekvencama pri istim uvjetima i s jednakim reakcijskim komponentama kao sekvenciranje početnicom ITS4. Stoga su za identifikaciju vrsta korištene dobivene sekvence iz jednog smjera duljine 641 do 680 bp. Korištenjem inačice algoritma Megablastza sekvence velike sličnosti (highly similar sequences) za svih šest sekvenci pronađena je podudarnost s već postojećima u NCBI GenBank bazi.
Rezultati nisu potvrdili prisutnost patogenih vrsta roda Phytophthora, već su pokazali da identificirane vrste pripadaju rodovima Pythium i Phytopythium (tablica 2). Tri izolata dobivena iz tla oko odumirućih stabala su identificirana su kao vrsta Phytopythium citrinum (B. Paul) Abad, De Cock, Bala, Robideau, Lodhi & Lévesque, dok su preostala tri koja su izolirana iz tla oko zdravih stabala identificirana kao tri različite vrste.
RASPRAVA I ZAKLJUČCI
DISCUSSION AND CONCLUSIONS
Do sada su u Hrvatskoj od gljivama sličnih organizama prisutnih u tlu istraživane jedino vrste roda Phytophthora, koje su potvrđene u tlima bukovih (Fagus sylvatica L.) sastojina na području Bjelovara te u tlima kultura topola (Populus x euroamericana)na području Osijeka i Valpova (Pernek i sur. 2011). Kako se vrste navedenog roda smatraju jednim od glavnih uzročnika odumiranja šumskog drveća u Europi (Jung i sur. 2013,Jankowiak i sur. 2014), ovim se istraživanjem nastojalo utvrditi mogućnost njihova sudjelovanja u odumiranju poljskog jasena u posavskim nizinskim šumama Republike Hrvatske. Iako su preliminarna istraživanja na uzorcima tla pomoću terenskih dijagnostičkih testova (eng. Pocket diagnostic test, Abingdon Health Ltd., UK) provedena u srpnju 2016. godine ukazala na prisutnost vrsta roda Phytophthora (Hegol 2016) u sastojinama poljskog jasena, iz uzoraka tla sakupljenih na istim lokacijama te analiziranih u ovom istraživanju su indirektnim metodama izolacije potvrđene isključivo vrste rodova Pythium i Phytopythium. Navedena činjenica ne umanjuje nužno vjerodostojnost terenskih testera, koji se i dalje mogu koristiti kao inicijalni pokazatelji prisutnosti vrsta roda Phytophthora, već može biti i posljedica manje zastupljenosti vrsta navedenog roda u tlu u odnosu na druge predstavnike gljivama sličnih organizama koji u kulturama micelija uzgojenim in vitro pokazuju brži rast te mogu znatno otežati identifikaciju sporije rastućih vrsta (Balcì i Halmschlager 2003a).
Miceliji gljivama sličnih organizamasu indirektnom metodom izolirani iz 24 od ukupno 30 analiziranih uzoraka tla, što upućuje na njihovu visoku zastupljenost u ovoj ekološkoj niši. Navedeni podatak ne iznenađuje s obzirom na činjenicu da se gljivama slični organizmi uglavnom šire zoosporama pokretljivim u vodi, a istraživane lokacije obuhvaćaju često plavljena staništa. Molekularne analize odabranih šest izolata su rezultirale identifikacijom čak četiri različite vrste dvaju rodova: Pythium i Phytopythium, ukazujući na visoku raznolikost ovih organizama u tlu. Pretpostavka je kako je zbog ograničenog broja uzoraka stvarna bioraznolikost gljivama sličnih organizama u tlu sastojina poljskog jasena veća od dobivene ovim istraživanjem.
Tri odabrana izolata dobivena iz uzoraka tla sakupljenih oko odumirućih stabala identificirana su kao Phytopythium citrinum, koja je do uspostave novog roda (Bala i sur. 2010,de Cock i sur. 2015) bila poznata kao Pythium citrinum B. Paul, a pokazala se učestalom i u tlima sastojina hrasta lužnjaka narušenog zdravstvenog stanja te riječnim tokovima u Poljskoj (Jankowiak i sur. 2015,Matsiakh i sur. 2016). Vrste Pythium lutarium Ali-Shtayehte Phytopythium litorale (Nechw.) Abad, De Cock, Bala, Robideau, Lodhi & Lévesque, prije poznata kao Pythium litorale Nechw., koje su izolirane iz uzoraka tla sakupljenog oko zdravih stabala, do sada nisu potvrđene u tlima šumskih sastojina u sličnim istraživanjima provedenim u drugim europskim državama, već jedino u vodenim tokovima u Poljskoj (Matsiakh i sur. 2016). S obzirom da su ostala istraživanja obuhvatila isključivo sastojine hrasta lužnjaka, može se zaključiti kako vrste posjeduju sklonost prema određenim staništima i/ili šumskim zajednicama, iako su za potvrdu takvog zaključka potrebni dodatni dokazi, odnosno ispitivanja na većem broju uzoraka. Vrsta Pythium anandrum Drechsler koja je potvrđena u uzorku tla sakupljenom oko zdravog stabla poljskog jasena, u većini se europskih istraživanja provedenih u lužnjakovim sastojinama opisuje kao najobilnija vrsta roda Pythium u tlu s visokom učestalošću izolacije (Jung i sur. 2000,Jönsson i sur. 2003,Balcì i Halmschlager 2003a,Balcì i Halmschlager 2003b,Jankowiak i sur. 2015), a navodi se i kao mogući patogen hrasta kitnjaka (Quercus petraea /Matt./ Liebl.)u Turskoj na temelju visoke zastupljenosti u tlima odumirućih sastojina i razvoja nekroza u testovima patogenosti provedenim na trogodišnjim sadnicama (Akilli i sur. 2013), te kao uzročnik odumiranja korijena na sadnicama obične smreke (Picea abies L. Karst) u rasadnicima u Norveškoj (Børja i sur. 2015).
Identifikacijom vrsta gljivama sličnih organizama u tlu odumirućih sastojina poljskog jasena u posavskim nizinskim šumama nije potvrđena prisutnost roda Phytophthora na istraživanim lokacijama, zbog čega će do daljnjih istraživanja ove vrste biti isključene kao jedan od mogućih čimbenika u kumulativnom i sinergijskom djelovanju na odumiranje poljskog jasena. Ulogu identificiranih vrsta rodova Pythium i Phytopythium u tlu tek treba dodatno razjasniti. Za sada nema sigurne potvrde o njihovoj povezanosti sa zdravstvenim stanjem šumskih sastojina, iako su poznate kao patogeni određenih poljoprivrednih kultura i šumskih sadnica u rasadnicima, te su vrlo česte u tlima odumirućih sastojina zajedno s vrstama roda Phytophthora (Jankowiak i sur. 2015).

