U liječenju onkoloških bolesnika, uz uobičajene standardne terapijske modalitete kojima se smatraju kirurško liječenje, kemoterapija, hormonoterapija, ciljana terapija i radioterapija, pokušavaju se primijeniti i postupci koji uključuju razne imunoterapijske pristupe. Pretpostavka imunoterapije ili imunoonkologije jest da imunosni sustav domaćina, odnosno bolesnika može prepoznati autologne tumorske stanice kao organizmu strane. Da se takvo što može očekivati, pokazuju brojni uspješni reproducibilni pokusi različitih stupnjeva složenosti ponajprije na singeničnim eksperimentalnim životinjama u kojih se postizalo izlječenje od autolognih tumora i u modelima metastatske bolesti. Izlječenje u tim eksperimentalnim modelima omogućavale su stanice imunosnog sustava ili razne solubilne molekule podrijetlom iz tih stanica (protutijela i razni citokini). Mogućnost imunosne reakcije protiv autolognih tumorskih stanica pokazuje, a u njihovoj usporedbi s normalnim stanicama, da su one antigenski različite. Ta je antigenska različitost uvjetovana ekspresijom tzv. „tumorskih antigena“. U tom kontekstu cilj je tumorske imunologije da se imunosnim sustavom i imunosnim mehanizmima u zdravih osoba ili osoba s rizikom postigne zaštita protiv tumora, a kod onkoloških bolesnika možda i izlječenje. U tumorskoj imunologiji očekivanja su analogna zaštiti koju imunosni sustav omogućuje protiv dijela zaraznih bolesti. Protiv tih bolesti imunosna se zaštita može postići prebolijevanjem ili preventivnom vakcinacijom (cijepljenjem). Prednost takve pokrenute ili izazvane imunosne reakcije protiv autolognih tumorskih stanica, a u usporedbi s, primjerice, kemoterapijom ili radioterapijom, jest razmjerno viša specifičnost liječenja s razmjerno nižom razinom mogućih nuspojava, kao i stvaranje imunosne memorije čime se postiže efikasna reaktivacija imunosnog sustava pri ponovnoj pojavi tumorskih stanica s istim antigenima.1–5
Zaštitna antitumorska imunosna reakcija u kliničkoj primjeni može biti pozicionirana u adjuvantnoj primjeni s preventivnom namjerom ili u stadiju metastatske bolesti s aktivnom terapijskom namjerom. Ipak, treba imati na umu da su našem imunosnom sustavu mikroorganizmi u usporedbi s vlastitim stanicama antigeno „puno više strani ili različiti“ pa, prema tomu, i lakše prepoznatljivi kao organizmu strani. Posljedično, mikroorganizmi osim što već budu razmjerno lakše prepoznati i od sustava prirođene imunosti, pokreću protiv sebe i razmjerno brže i intenzivnije imunosne reakcije stečene imunosti koju karakterizira imunosna specifičnost i imunosna memorija. Za razliku od mikroorganizama, tumorske stanice potječu od genetski alteriranih vlastitih stanica pa se postavlja i pitanje postojanja (kvalitete) i kvantitete antigenske različitosti. Isto tako, spoznalo se i da tumorski stanični mikrookoliš sa svojim metaboličkim specifičnostima i sastavom stanica od kojih neke pripadaju imunosnom sustavu i imaju regulacijske funkcije, može vrlo često imati negativan (supresorski) učinak na imunosne stanice usmjerene na uklanjanje autolognih tumorskih stanica. Nadalje, kako tumorske stanice imaju svakako i molekule (antigene) koji nisu različiti od onih u normalnih stanica, u imunosnim staničnim interakcijama s tumorskim stanicama mogu biti aktivni i fiziološki mehanizmi imunosne tolerancije. Ti mehanizmi mogu otežavati ili sprečavati imunosnu reakciju protiv autolognih tumorskih stanica. Tako pri aktivaciji tih regulacijskih stanica imunosnog sustava sa „supresorskom“ ulogom u konačnici mogu prevladati mehanizmi tolerancije, a ne mehanizmi citotoksičnosti protiv autolognih tumorskih stanica. Stoga je, realno gledajući, imunosno prepoznavanje i pokretanje zaštitne imunosne reakcije protiv autolognih tumorskih stanica, a u odnosu prema mikroorganizmima ili alogenim transplantatima, neizvjesnije. Također, same tumorske stanice koje su genski nestabilne i heterogene, u situaciji izloženosti imunosnim reakcijama protiv sebe, mogu biti selekcionirane da preživljavaju antigeno negativne varijante ili varijante tumorskih stanica koje su otpornije na imunosne „napadaje“ protiv sebe. Isto tako, preživjele tumorske stanice u staničnim interakcijama s drugim stanicama u tumorskome staničnom mikrookolišu mogu stvarati imunosupresivni mikrookoliš ili kroničnoupalni okoliš s imunim stanicama i citokinima koji može favorizirati proliferaciju i progresiju tumorskih stanica.1–5
Tumorska imunologija i klinička primjena
Tumorska imunologija kao terapijski modalitet protiv autolognih tumora ima kontinuirane oscilirajuće pokušaje kliničke primjene koji su zabilježeni još krajem 19. stoljeća (kirurg W. B. Coley i tzv. imunomodulatorni „Coleyjev toksin“) pa sve do današnjih dana. U toj vremenskoj skali u rasponu većem od stotinu godina tumorska je onkologija imala faze entuzijazma, ponajprije intelektualno-idejne, a koje usprkos uspješnim rezultatima na eksperimentalnim životinjama nisu slijedili uspješni reproducibilni klinički rezultati pa bi opet slijedile faze „mirovanja“ u smislu kliničke primjene. U pedesetim godinama prošlog stoljeća svakako valja istaknuti ideju tzv. „imunosnog nadzora“ (engl. immunosurveillance; M. Burnet i L. Thomas) u smislu važnog idejnog koncepta.6 Prema pretpostavci imunosnog nadzora, jedna od fizioloških funkcija imunosnog sustava bila bi i prepoznavanje i uklanjanje aberantnih (tumorskih) vlastitih stanica.3,6,7 S druge strane, tumorske stanice u tim staničnim interakcijama mogu pod selektivnim imunosnim pritiskom izgubiti antigene, postati „neprepoznatljive“ imunosnom sustavu, a to bi bila karakteristika klinički evidentnih tumora. Isto tako tumorske stanice i stanični mikrookoliš tumora sa svojim sastavom, uključujući i stanice imunosnog sustava, mogu čak favorizirati imunosnu nereaktivnost protiv tumorskih stanica pa i poticati njihov rast i razmnožavanje. Poznat je utjecaj kroničnih upalnih stanja na malignu transformaciju usprkos nazočnosti stanica imunosnog sustava. U tome mogu (paradoksalno) djelovati i pojedine sastavnice imunosnog sustava (podtipovi regulacijskih stanica i molekule). Konačni efekt u smislu djeluje li imunosni sustav u određenoj situaciji i fazi razvitka tumora antitumorski ili protumorski, ovisi i o odnosu tih pojedinih sastavnica imunosnog sustava. Prema pretpostavci imunosnog nadzora, bez njega bi učestalost tumora bila znatno viša jer imunosni sustav aktivno i najvećim dijelom uspješno uklanja antigeno aberantne (tumorske) stanice. Tumorske stanice koje prežive imunosni nadzor zapravo su selekcionirane na „preživljavanje“. One se selekcijom antigeno zasigurno razlikuju od početnih tumorskih stanica preteča (manje su imunogenične) ili su regulacijski mehanizmi onemogućili zaštitnu antitumorsku imunosnu reakciju. U takvoj situaciji gdje autologne tumorske stanice izbjegnu pretpostavljenom imunosnom nadzoru imamo pojavu klinički evidentnih tumora. Ne samo eksperimentalni modeli već i pojedina klinička opažanja i nalazi, ponajprije u bolesnika koji primaju imunosupresivnu terapiju, podupiru koncept „imunosnog nadzora“. Tako u tim interakcijama „imunosnog nadzora“ između imunosnog sustava i autolognih stanica možemo imati fazu uništenja tumorskih stanica. Ako se ne uspiju ukloniti sve tumorske stanice, može i dalje postojati jedna faza nesigurne ograničene kontrole ili „ravnoteže“ u nadzoru. Ako se u cijelosti izgubi mogućnost nadzora, nastat će sljedeća faza „bijega“ preživjelih i selekcioniranih tumorskih stanica iz imunosnog nadzora s pojavom klinički evidentnih tumora (primarni tumori ili relaps bolesti). Ta pojava tumora u imunosno kompetentnih osoba sugerira da je „imunosni nadzor“ samo jedna faza mogućih interakcija između imunosnog sustava i autolognih tumorskih stanica pa se u današnje vrijeme govori o tzv. „imunosnom uređivanju tumora“ (engl. cancer immunoediting). To bi uređivanje uključivalo ove faze u dinamičkim interakcijama: faza eliminacije (engl. tumor elimination phase), faza ravnoteže s „uspavanim“ tumorskim stanicama (engl. equilibrium state with dormant tumor cells) i faza bijega tumorskih stanica (engl. tumor escape phase).2,8,9
Neovisno o gore navedenom idejnom konceptu imunosnog uređivanja tumora, rezultati u bazičnotranslacijskim istraživanjima i u kliničkoj primjeni od devedesetih godina prošlog stoljeća pa do danas postavljaju ponovo fazu „entuzijazma“ u imunoonkologiji. Primjerice, postiže se identifikacija gena koji određuju tumorske antigene u onkoloških bolesnika i njihovo molekularno karakteriziranje, a koje prepoznaje imunosni sustav bolesnika. Ti rezultati omogućuju razne pristupe vakcinacije odnosno izazivanja „aktivne“ imunosti u bolesnika. Primjerice, vakcinacije sintetiziranim tumorskim antigenima pa do transfekcije tumorskih stanica ili stanica koje prezentiraju antigen s genima koji određuju potencijalne tumorske antigene i imunostimulatorne citokine. Antigeni koje imunosni sustav može prepoznati na autolognim tumorskim stanicama mogu biti tzv. „neoantigeni“, koji nastaju kao posljedica somatskih mutacija gena u tumorskim stanicama tijekom procesa zloćudne transformacije ili stvaranjem „novih“ gena na mjestima kromosomskih translokacija s posljedicom sinteze novih molekula, odnosno antigena. Drugi izvor potencijalnih antigena (tzv. „antigeni pridruženi tumorȕ“) može biti povećana ekspresija normalnih molekula u tumorskim stanicama, a kao posljedica povećanog broja kopija pojedinih gena (primjer pozitiviteta HER-2). Također, zbog epigenetskih poremećaja može doći do aberantne vremenske i topografske ekspresije gena, odnosno antigena. Primjerice, antigeni raka testisa s ekspresijom u tumorskim stanicama ili primjer alfa-fetoproteina kao onkofetalnog antigena.10–14
Pojavljuju se i kliničke studije s uzgojem, aktivacijom, selekcijom i umnožavanjem potencijalnih antitumorskih limfocita in vitro iz bolesnika (ponajprije s metastatskim melanomom) i njihova vraćanja s terapijskom (antitumorskom) svrhom u bolesnike. Slijede i studije s primjenom slično uzgojenih limfocita in vitro s tzv. „kimeričnim antigenskim receptorima“ (engl. Chimeric Antigen Receptors – CARs). Uz te, u praksi razmjerno tehnološki i infrastrukturno kompleksne pristupe u smislu „pasivne“ imunosti, postoje i oni razmjerno jednostavniji u smislu kliničke primjene. Primjeri su pristupi s unosom monoklonskih protutijela protiv antigena na tumorskim stanicama ili primjena raznih imunostimulatornih citokina (na prvome mjestu visokodozni rekombinantni interleukin 2 (rIl-2)) ili s drugim molekulama možda sličnoga nespecifičnog imunostimulatornog djelovanja. Treba imati na umu da pojedina primijenjena monoklonska protutijela koja se inače upotrebljavaju u liječenju onkoloških bolesnika kao tzv. „ciljani lijekovi“ u takvome liječenju ne moraju izazivati imunosne reakcije protiv tumorskih stanica, već mogu djelovati u prvom redu drugim mehanizmima. Primjerice, kao lijekovi u smislu inhibicije molekularnih interakcija između raznih aktivacijskih liganada (faktori rasta) i receptora na staničnoj površini (npr., anti-HER-2-protutijela). Inhibicijom tih molekularnih interakcija blokiraju se razni stimulacijski signali koji se prenose molekularno-kaskadno od stanične membrane pa do molekule DNK u jezgri, gdje u konačnici potiču proliferaciju i druge biološke procese i u normalnih stanica i u tumorskih.1–5,15
Tumorska imunologija primjenom protutijela s funkcijom blokade kontrolnih molekularnih interakcija u staničnim interakcijama negativne povratne sprege
Unatrag posljednjih nekoliko godina, zahvaljujući terapijskoj uspješnosti u klinici i razmjerno jednostavnoj primjenjivosti (humanizirana monoklonska protutijela), počinje se etablirati u praksi do tada idejno novi imunoterapijski pristup, usmjeren protiv inhibicijskih mehanizama imunosnog sustava, odnosno protiv regulacijskih molekula tog sustava. Tim se pristupom postiže blokada inhibicijskih regulacijskih mehanizama („blokada blokade“), odnosno olakšava se aktivacija ili reaktivacija T-limfocita koji mogu djelovati protiv autolognih tumora. Monoklonska protutijela koja se primjenjuju ne djeluju izravno na tumorske stanice, već blokadom blokade aktiviraju možda „zakočeni“ imunosni sustav.1–5,16
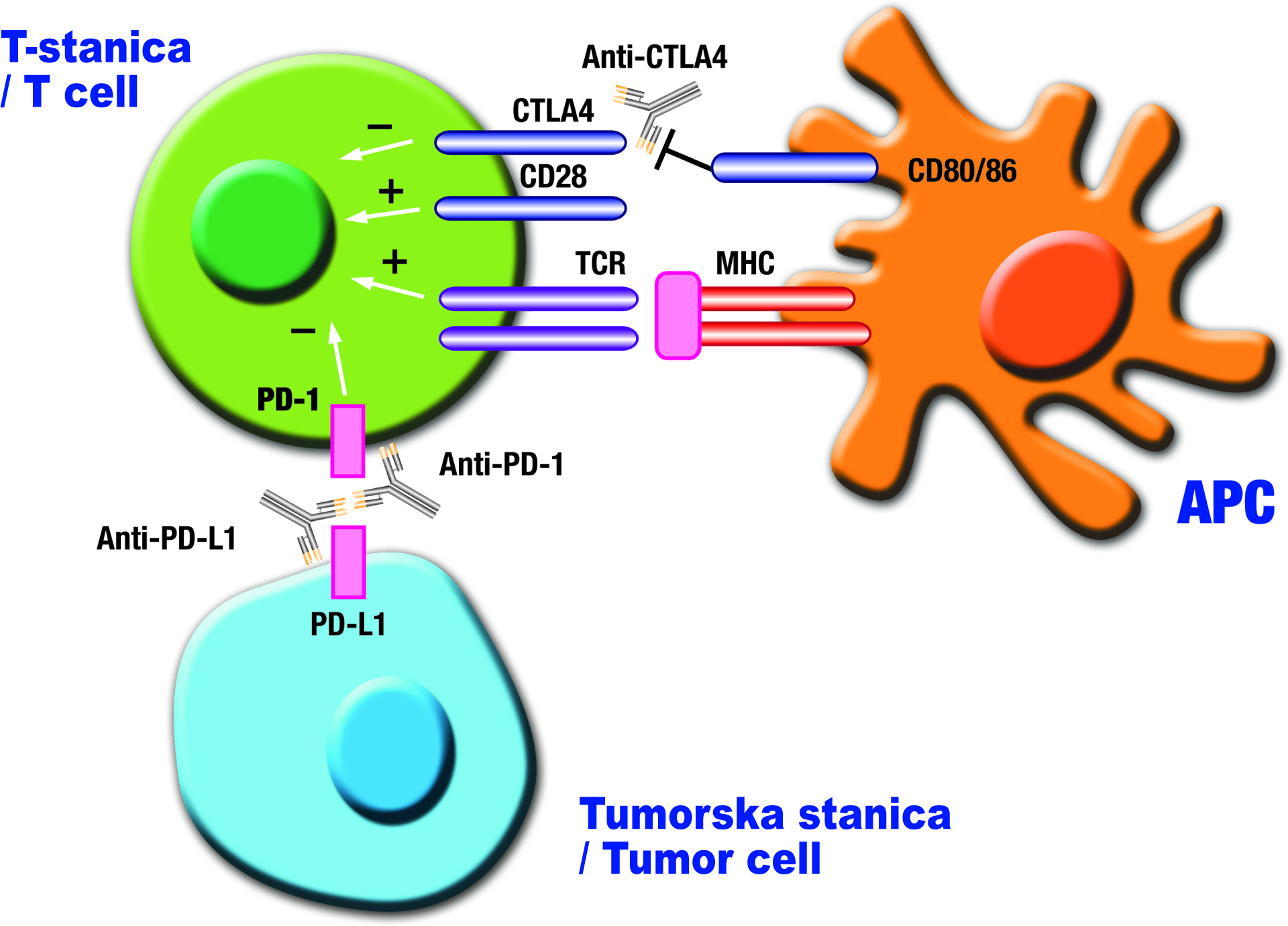
Ukratko, fiziološka aktivacija T-limfocita uz prepoznavanje antigena putem receptora specifičnog za antigen (tzv. „prvi signal“) iziskuje i dodatne kostimulacijske interakcije preko drugih molekula (tzv. „drugi signal“). Receptor specifičan za antigen u T-limfocita, odnosno T-limfociti prepoznaju peptidne antigene u obliku molekularnog kompleksa s molekulama glavnog kompleksa tkivne snošljivosti na drugim stanicama. Te druge stanice mogu biti tzv. stanice koje prezentiraju antigen, primjerice, dendritičke stanice u aferentnoj fazi imunosne reakcije ili druge (ciljne) stanice, primjerice, u eferentnoj fazi imunosne reakcije. U molekularnim interakcijama „drugog signala“ također imamo interakcije tipa receptor – ligand, gdje su „receptorske“ molekule na T-limfocitima, a molekule ligandi su na drugim stanicama. Primjer molekula koje su uključene u tzv. „drugi signal“ jesu molekula CD28 na T-limfocitima i molekule ligandi CD80 (B7-1) / CD86 (B7-2) na dendritičkim stanicama. Nakon aktivacije u T-limfocita fiziološki dolazi do pokretanja genetskih programa koji rezultiraju proliferacijom i funkcionalnom diferencijacijom T-limfocita. Dolazi i do egzocitoze vezikula s molekulama CTLA-4 (engl. cytotoxic T-lymphocyte antigen 4; CD152) koja je homolog molekule CD28, odnosno do ekspresije molekula CTLA-4 na staničnoj membrani aktiviranih T-limfocita. Preko molekula CTLA-4 koje stimuliraju ligand pokreću se u aktiviranim T-limfocitima unutarstanični molekularni signali negativne povratne sprege, odnosno sprečava se razvitak „prejake“ imunosne aktivacije i reakcije u aferentnoj fazi imunosne reakcije. Molekule CTLA-4 i CD28 tada su u međusobnoj kompeticiji za molekule B7, ali molekule CTLA-4 imaju veći afinitet od molekula CD28 za interakcije s molekulama B7 i tako nakon početne aktivacije T-limfocita dolazi do „kočenja“ njihove aktivacije (slika 1.). Valja napomenuti da postoje i druge molekule na T-limfocitima i molekule ligandi na drugim stanicama koje također čine „druge aktivacijske signale“, a koje su predmet kliničkih studija, primjerice, molekula OX40 (CD134) na T-limfocitima i ligand OX40L (CD252).1–5,16–19
Nadalje, uvidjelo se da fiziološki postoje i drugi mehanizmi negativne povratne sprege, koji se zbivaju isto tako putem drugih sličnih molekularnih interakcija tipa receptor – ligand u eferentnoj fazi imunosne reakcije, gdje su također „receptorske“ molekule na T-limfocitima, a ligandi na drugim stanicama. S imunosnoregulacijskog aspekta govori se o molekulama sustava kontrolnih točaka (engl. checkpoint) koji omogućava fiziološku regulaciju aktivacije i trajanje aktivacije stanica imunosnog sustava, u ovom slučaju T-limfocita. Fiziološka je uloga tog sustava i mehaniza-
ma negativne povratne sprege prevencija prejake aktivacije T-limfocita, radi izbjegavanja mogućih autoimunosnih reakcija i minimaliziranja stanično-tkivnih oštećenja tijekom tih reakcija. Primjer molekula u sustavu negativne povratne sprege u eferentnoj fazi imunosne reakcije jesu molekula „PD-1“ (protein programirane smrti 1; engl. programmed cell death protein 1; CD279), koja je također član porodice B7/CD28 kostimulacijskih receptora i nalazi se na T-limfocitima. PD-1 regulira aktivaciju T-limfocita interakcijom (vezanjem) s ligandima „PD-L1“ (CD274) ili s „PD-L2“ (CD273). Ta interakcija također inhibira proliferaciju T-limfocita, smanjuje njihovo preživljavanje, smanjuje se sekrecija interferona-gama (engl. interferon-gamma – IFN-γ), faktora nekroze tumora-alfa (engl. tumor necrosis factor-alpha – TNF-α) i interleukina 2 (interleukin 2, IL-2). Prevenira se i fosforilacija molekula u prijenosu aktivacijskih signala u T-limfocita nakon prepoznavanja antigena od
T-limfocitnog receptora specifičnog za antigen. Posljedično, smanjena je aktivacija T-limfocita, oni ulaze u stanje „iscrpljenosti“ (tzv. „anergije“). To se stanje T-limfocita uočava u kroničnim infekcijama i kod tumora.
Ako na tumorskim stanicama postoje takvi „inhibirajući“ ligandi, a oni se tu mogu naći jer se fiziološki mogu nalaziti na normalnim stanicama, možemo imati situaciju funkcionalne inaktivacije i nereaktivnosti protiv autolognih tumorskih stanica. Isto tako, mehanizmi negativne povratne sprege mogu i u aferentnoj fazi imunosne reakcije dovesti do abortivne imunosne reakcije (nema razvitka antitumorske reakcije).16–19 Važnost tih mehanizama negativne povratne sprege u antitumorskoj imunosti dokazao je na eksperimentalnome životinjskome modelu 1996. g. imunolog Allison sa suradnicima kada je uporabom protutijela koje blokira interakciju između receptora i liganda u negativnoj povratnoj sprezi izazvao zaštitnu staničnu antitumorsku imunost („blokada blokade“).20 Daljnja klinička istraživanja u onkoloških bolesnika s monoklonskim protutijelima koja „blokiraju blokadu“ dovela su do terapijski uspješnih rezultata u smislu vjerojatnog izlječenja dijela onkoloških bolesnika s određenim tumorima u stadijima metastatske bolesti. Primijenjena protutijela ne djeluju izravno na tumorske stanice, već blokadom blokade aktiviraju „zakočeni“ imunosni sustav. Publicirani rezultati kliničkih studija faze 3 pojavili su se prvo 2010. godine i one i dalje slijede. U tim kliničkim studijama upotrijebljena su humanizirana monoklonska protutijela protiv molekula/receptora na T-limfocitima s inhibicijskom funkcijom „CTLA-4“ i „PD-1“ ili protiv inhibicijskog liganda na „ciljnim“ stanicama „PD-L1“ i „PD-L2“. Slijedile su ubrzane registracije, odnosno odobrenja za primjenu tih protutijela u pojedinih metastatskih tumora (za melanom, rak pluća, rak bubrega, Hodgkinov limfom, planocelularni rak glave i vrata, rak mokraćnog mjehura). Nuspojave primjene tih monoklonskih protutijela koja blokiraju blokadu tipa su raznih autoimunosnih reakcija različita intenziteta; rjeđe su infuzijske reakcije.1–3,16–19 Prvo odobreno humanizirano monoklonsko protutijelo bio je ipilimumab (anti-CTLA-4) s indikacijom za liječenje bolesnika s metastatskim melanomom.21 Bolesnici s tim melanomom u prvoj su kliničkoj studiji faze 3 randomizirani da primaju ipilimumab (3 mg/kg tjelesne mase u četiri trotjedna ciklusa) s peptidnom vakcinom gp100, ipilimumab u kombinaciji s placebom ili vakcinu gp100 s placebom. Medijan preživljenja bolesnika koji su primili ipilimumab s vakcinom gp100 ili bez nje bio je 10,0, odnosno 10,1 mjesec, a onih koji su primili samo vakcinu gp100 6,4 mjeseca; p < 0,001, odnosno p = 0,003.21 Poslije su slijedila odobrenja za protutijela nivolumab (anti-PD-1)22 i pembrolizumab (anti-PD-1).23 Uz ta, povijesno prva odobrena humanizirana anti-checkpoint monoklonska protutijela, postoje i druga u raznim fazama testiranja i/ili odobrenja za liječenje bolesnika s metastatskom bolesti. Primjerice, tremelimumab (anti-CTLA-4), pidilizumab (anti-PD-1), AMP-514 (anti-PD-1), AUNP-12 (anti-PD-1), BMS936559 (anti-PD-L1), atezolizumab (anti-
-PD-L1), durvalumab (anti-PD-L1), avelumab (anti-PD-L1), AMP-224 (anti-PD-L2).24,25
Rezultati kliničke primjene gore navedenih protutijela protiv molekula sustava kontrolnih točaka (engl. immune anti-checkpoint blockade therapy) unijeli su novu fazu entuzijazma u tumorsku imunologiju. Dobiveni su rezultati u smislu dugotrajnije regresije tumora u dijela bolesnika, a možda su postignuta i izlječenja. Primjerice, grafički prikazi krivulja preživljenja liječenih skupina bolesnika u kliničkim studijama s protutijelima protiv molekula sustava kontrolnih točaka pokazuju, u usporedbi s osi X (apscisa) koja se odnosi na vrijeme praćenja bolesnika, nakon inicijalnog pada pojavu razmjernog odmaknutoga, dugotrajnog i paralelnog platoa s osi X. Takvi rezultati upućuju, ponavljamo, na dugo vrijeme bez progresije bolesti ili na moguće izlječenje. Za razliku od toga u (kontrolnih) bolesnika liječenih kemoterapijom dolazi do „dodirivanja“ krivulje preživljenja s apscisom; nema preživljenja ili se u praćenih bolesnika ono postiže samo u nekoliko posto bolesnika. U tom kontekstu uspješnosti valja istaknuti, primjerice, kliničku studiju faze 3 s pembrolizumabom u prvoj liniji liječenja metastatske bolesti u bolesnika s rakom pluća nemalih stanica. Jedan od kriterija uključivanja bio je imunohistokemijski pozitivitet ekspresije PD-L1 u 50% ili više tumorskih stanica. Bolesnici u kontrolnoj skupini primali su kemoterapijski standard, tj. kemoterapiju baziranu na citostatiku cisplatini. Bolesnici na pembrolizumabu imali su statistički značajno duže preživljenje bez progresije bolesti (10,3 mjeseca nasuprot 6,0 mjeseci; p < 0,001). Razlika je bila i u sveukupnome šestomjesečnom preživljenju (80,2% bolesnika nasuprot 72,4% bolesnika; p = 0,005), u stupnju postotka bolesnika u odgovoru (44,8% nasuprot 27,8%) i u medijanu trajanja odgovora (u skupini na pembrolizumabu medijan nije još dosegnut nasuprot 6,3 mjeseca). Također, bolesnici na pembrolizumabu imali su nižu učestalost nuspojava.26
Gore navedena monoklonska protutijela razmjerno se dobro podnose, daju se bez specifične premedikacije (bez kortikosteroida koji djeluju imunosupresivno), tj. bez premedikacija koje se uobičajeno daju kod kemoterapijskih protokola. Treba biti svjestan mogućeg rizika od infuzijske reakcije, ali i autoimunosnih nuspojava i tada postoji opcija primjene kortikosteroida ili druge antiinflamatorne terapije (npr., anti-TNF-protutijela). Nadalje, od početka primjene protutijela do kontrole tumora može slijediti razdoblje od više tjedana pa do više mjeseci. U tom se periodu može steći i lažan dojam progresije tumorske bolesti (pseudoprogresija). Postoje, štoviše, i izvještaji o regresiji bolesti u bolesnika u kojih je zbog „zamjene“ pseudoprogresije s progresijom bolesti liječenje bolesnika prekinuto. Zapravo, u tih se bolesnika pokrenula ili aktivirala antitumorska imunost koja je djelovala i nakon prestanka apliciranja anti-checkpoint protutijela.1–3,16–19
Kako se kontrola tumorske bolesti postiže samo u dijela liječenih bolesnika, dio istraživanja u vezi s primjenom anti-checkpoint terapije usmjeren je i k nalaženju primjenjivih i reproducibilnih prediktivnih parametara ili biomarkera. Opaženo je da su takvoj vrsti imunoterapije podložniji tumori s razmjerno većim brojem mutacija (to su gore navedeni tumori), zatim bolesnici u čijih se tumora opaža razmjerno opsežnija limfocitna infiltracija, odnosno nalaze se obrasci ekspresije gena imunosnih stanica (engl. immune signatures) koji odgovaraju tzv. staničnom imunosnom odgovoru, kao i možda povećana ekspresija molekule PD-L1 (ekspresija na tumorskim stanicama). Zbog razmjerne praktičnosti u smislu imunohistokemijske ekspresije molekule PD-L1 pojedine vrijednosti pozitivnosti uzimaju se kao kriteriji uključivanja bolesnika u kliničke studije ili u terapiju. S druge strane, na terapiju anti-checkpoint antitijelima mogu odgovoriti i bolesnici s PD-L1-negativnim tumorima. Za sada još nema zadovoljavajućih prediktivnih biomarkera, odnosno njihove standardizacije, što, zapravo, ne iznenađuje jer između stanica imunosnog sustava i tumorskih stanica u individualnih bolesnika postoje i dinamičke interakcije i moguća heterogeničnost u smislu ekspresije potencijalnih tumorskih neoantigena te stanične gustoće i sastava stanica imunosnog sustava u tumoru i oko njega.1–5,27,28,29–31
U zaključku, valja očekivati da će imunoterapija (imunoonkologija) putem primjene protutijela koja blokiraju interakcije između molekula u imunosnim mehanizmima negativne povratne sprege postati sastavni dio terapijskog arsenala u liječenju bolesnika s pojedinim tipovima tumora. Isto tako, primjena tih protutijela u kombinaciji s antitumorskim vakcinama može omogućiti i klinički uspješnu primjenu ranijih vakcina koje su bile racionalno konstruirane i primijenjene, ali nisu uspjele izazvati terapijski učinkovitu ili zaštitnu antitumorsku imunost.2,3,32,33