UVOD
Od pojave prvih komercijaliziranih genetički modificiranih poljoprivrednih kultura koncem prošloga stoljeća do danas, površine zasijane genetički modificiranim organizmima (GMO), kao i broj modifikacija, u stalnome su porastu. Primjena tehnika genetičkoga inženjerstva dovela je do svojevrsne revolucije u poljoprivredi, omogućući brz razvoj kultivara otpornih na herbicide, štetnike i bolesti ili kultivara poboljšanoga nutritivnog sadržaja. Porastom broja modifikacija posljedično dolazi i do porasta broja metoda za praćenje takvih proizvoda na tržištu, te uobičajene strategije otkrivanja prisutnosti genetički modificiranih organizama u poljoprivrednim proizvodima zahtijevaju nov pristup i strategiju koja će smanjiti broj analitičkih koraka, a istovremeno jamčiti uspješnost monitoriranja (Querci i sur, 2010).
Europsko zakonodavstvo koje regulira pitanje genetički modificiranih proizvoda zasniva se na dva osnovna zahtjeva: prije stavljanja na tržište svaki GMO mora proći procjenu rizika utjecaja na ljude, životinje i okoliš te za njega mora biti osigurana metoda detekcije. Prema Uredbi (EU) 2017/625, Referentni laboratorij Zajednice validira metode i objavljuje ih u važećim registrima, a nacionalno zakonodavstvo propisuje obveznu uporabu ovih metoda za službene kontrole, odnosno monitoring (EU Register of authorized GMOs, 2024). Monitoring ima za cilj utvrditi sadrži li proizvod genetički modificirane organizme te je li utvrđena modifikacija odobrena za stavljanje na tržište, odnosno je li prošla procjenu rizika. U uzorcima kod kojih je potvrđena prisutnost nekoga GMO-a potrebno je utvrditi koliki je njegov kvantitativni sadržaj (Hilbeck, 2020). Metoda izbora jest metoda lančane reakcije polimerazom u stvarnome vremenu (Real Time PCR, qPCR). Ova metoda dokazano je najtočnija i najpouzdanija za detekciju GMO-a, visoko je specifična i primjenjiva na širok raspon uzoraka, od sjemena do visoko prerađene hrane i hrane za životinje (A ngers – Loustau i sur., 2014; Holst – Jelsen i sur., 2012).
Trenutačno na europskome tržištu postoji velik broj odobrenih modifikacija, ali i onih kojima je isteklo odobrenje ili su odobrene izvan Europske unije. Kontinuirano povećanje broja modifikacija na europskome i globalnom tržištu predstavlja izazov u kontroli i praćenju GMO-a. Povećavanjem broja modifikacija raste i broj metoda njihova otkrivanja, analize su sve složenije, broj analitičkih koraka koje je potrebno provesti po jednome uzorku sve je veći, a analize su financijski i vremenski sve zahtjevnije. Zbog svega navedenoga nužan je optimalan odabir strategije u analizi uzoraka koji će pružiti zadovoljavajući rezultat, a istovremeno omogućiti optimizaciju troškova analize i potrebnoga vremena (Rosa i sur., 2016; Rostoks i sur., 2019).
MATERIJALI I METODE
U radu su korišteni uzorci sjemena soje, kukuruza i uljane repice zaprimljeni u Odjelu za biotehnološke analize, mikotoksine i rezidue pesticida Centra za sjemenarstvo i rasadničarstvo Hrvatske agencije za poljoprivredu i hranu (CSR, HAPIH) u sklopu službenih kontrola. Uz uzorke sjemena kao pozitivne kontrole korišteni su certificirani referentni materijali za GMO JRC (Joint Research Centre) i AOCS (American Oil Chemists’ Society) normalizirani na 0,1 % sadržaja GMO‐a.
Genomska DNK izolirana je iz uzoraka sjemena i certificiranoga referentnog materijala metodom s 2 % CTAB pufera (Hanzer, 2019), a provjera kakvoće i prinosa DNK provjerena je UV spektrofotometrijom (BioPhotometer, Eppendorf). Otopina DNK i standardi normalizirani su na 50 µg/ml. Utvrđivanje prisutnosti karakterističnih DNK slijedova za GMO odrađeno je qPCR metodom s pomoću TaqMan kemije (Navarro i sur., 2015). Korištene početnice i fluorescirajuće probe prikazane su u Tablici 1. (Vanden Eede, 2011.). Svaki uzorak analiziran je u dvama ponavljanjima.
Tablica 1. Popis početnica (3'-5' i 5'-3') i TaqMan proba korištenih u analizi.
Table 1 A list of primers (3'-5' and 5'-3') and the TaqMan probes used in the analyses.
REZULTATI I RASPRAVA
Više autora donosi različite strategije za otkrivanje prisutnosti genetički modificiranih organizama u sjemenu. Sve za cilj imaju utvrditi kako s minimalnim brojem analiza za svaku biljnu vrstu osigurati potpunu (ili što veću) pokrivenost u skladu sa zakonski propisanim uvjetima (Bof ini, 2021.). Gledano kroz povijest, u prvim godinama provedbe monitoringa umnažanje svega dvaju probirnih elemenata, promotora 35S i terminatora NOS, omogućivalo je preko 90 % pokrivenosti genetički modificiranih organizama na tržištu (Hardegger i sur., 1999.). Danas bi takav pristup mogao biti primijenjen jedino na kukuruz, dok je za druge biljne vrste potreban složeniji pristup, koji kombinira tri tipa metoda različite specifičnosti umnažanja (Slika 1.). Probirne metode podrazumijevaju umnažanje dijela konstrukta unesenoga u genom biljke domaćina bilo da se radi o promotorskim i teminatorskim regijama bilo o samome konstruktu, nositelju novoga svojstva. Takve metode omogućuju identifikaciju neovisnu o biljnoj vrsti i pokrivanje velikoga broja različitih GMO-a, koji u svojem genomu sadrže neke od navedenih sekvenca. S druge strane, GMO specifične metode umnažaju samo mjesto umetanja konstrukta u genom biljke domaćina i omogućuju identifikaciju GMO-a (Hanzer i sur., 2012; Gerdes i sur., 2012.).
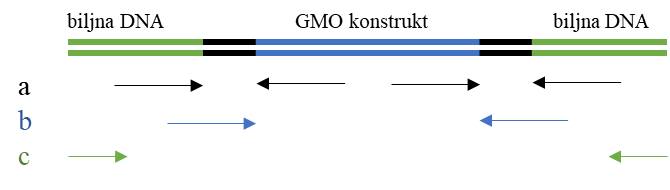
Slika 1. Prikaz različitih tipova metoda za detekciju genetičkih modifikacija (a: detekcija promotorske i terminatorske regije; b: detekcija GMO konstrukta, c: GMO specifična detekcija).
Figure 1 A presentation of different methods for the detection of genetic modifications (a: detection of promoter and terminator regions; b: detection of GMO constructs, c: GMO‐specific detection).
Trenutačno na svjetskome tržištu postoje stotine različitih modifikacija. Uporaba PCR analiza za svaku od modifikacija nerealna je s obzirom na potrebno vrijeme za takav pristup, kao i trošak. Kontinuirani porast GMO-a traži razvoj strategija koje će omogućiti donošenje zaključka o prisutnosti/odsutnosti što većega broja modifikacija u uzorku s razumnim brojem qPCR analiza (Broeders i sur., 2012.). Uzimajući u obzir trenutačno stanje na europskome tržištu i zahtjeve nacionalnoga zakonodavstva, implementirana je strategija koja kombinacijom svih triju tipova metoda za detekciju omogućuje potpunu pokrivenost trenutačno odobrenih modifikacija, uvažavajući „nultu toleranciju“ na prisutnost GMO-a u sjemenu na području Republike Hrvatske (Rostoks i sur., 2019.). Tablica 2. prikazuje postotak pokrivenosti modifikacija s pomoću dostupnih probirnih elemenata, koji se kreće od 83,33 % za soju do 92,31 % za kukuruz. Kombinacijom elemenata probira i GMO specifičnih metoda moguće je postići 100%‐tnu pokrivenost za ukupno 25 genetički modificiranih soja, 43 kukuruza i 17 genetički modificiranih uljanih repica zastupljenih u registru metoda (Bofini i sur., 2012.).
Tablica 2. Postotak pokrivenosti modifikacija navedenih u GMO registru EU‐a uporabom elemenata probira i kombinacijom elemenata probira i GMO specifičnih metoda.
Table 2 The coverage percentage of modifications listed in the EU GMO register using the screening elements and a combination of the screening elements and the GMO‐specific methods.
Pristup detekciji genetički modificiranih organizama koji uključuju probirne elemente u svrhu pokrivanja širokoga raspona modifikacija postao je uobičajen za sve laboratorije koji provode službene kontrole. Uzimajući u obzir specifičnosti na nacionalnoj razini, kao i dostupnost metoda, opreme, visokokvalificiranoga kadra te zahtjeve akreditacijskih tijela, svaki laboratorij u okviru svega navedenoga razvija svoju metodologiju, koja u konačnici mora jamčiti uspješnu provedbu nacionalnoga i europskog zakonodavstva. Temelj svega jest zajednička strategija koju je razvila Europska mreža GMO laboratorija ENGL, takozvani princip matrice, koji je temeljni princip implementiran u rad ovlaštenih laboratorija na području RH (Block i sur., 2013.). Republika Hrvatska ističe se kao zemlja članica EU‐a s izrazito strogim nacionalnim zakonodavstvom te je trenutačno na snazi za područje cijele države takozvana nulta toleranca na sijanje svih GMO-a (Davison i Ammann, 2017.; Commission Implementing Decision (EU) 2016/321, 2016.).
Strategija matrice koja uključuje kombinaciju probirnih elemenata i GMO specifičnih metoda daje jednaku pokrivenost kao i analiza svakoga modificiranog organizma pojedinačno, uz značajno manji broj qPCR analiza, što u konačnici štedi vrijeme i novac. Najznačajnije smanjenje broja analitičkih koraka vidljivo je kod kukuruza, gdje se 43 modifikacije uporabom ove strategije mogu pokriti dvjema qPCR analizama za 92,31 % pokrivenosti, odnosno s četirima za 100 % pokrivenosti. Značajno smanjenje analitičkih koraka je i kod analize uljane repice, gdje je za 100%‐tnu pokrivenost dovoljno pet qPCR analiza, dok je kod soje potrebno osam. Iako smanjenje broja analitičkih koraka kod soje nije toliko značajno kao kod drugih kultura, ono još uvijek nudi rješenje koje će jamčiti potpunu pokrivenost u skladu sa zakonski propisanim zahtjevima, a analiza će ostati u razumnim vremenskim i financijskim okvirima (Slika 2.).
Slika 2. Broj PCR analiza potreban za detekciju modifikacija navedenih u GMO registru EU‐a za najzastupljenije kulture ( slijeva nadesno za svaku biljnu vrstu: GMO specifične metode, probirni elementi, kombinacija probirnih elemenata i GMO specifičnih metoda).
Figure 2 The number of PCR analyses required for the detection of modifications listed in the EU GMO register for the most represented crops (from the left to the right for each plant species: GMO‐specific methods, screening elements, combination of screening elements, and GMO‐specific methods).
ZAKLJUČAK
Primjena matrice za izbor metoda probira nudi sveobuhvatnu analizu prisutnosti genetički modificiranih organizama u sjemenu soje, kukuruza i uljane repice. Kako bi što učinkovitije pokrili modifikacije za koje su metode detekcije dostupne, u skladu s dostupnim resursima implementirana je gore opisana strategija za najzastupljenije poljoprivredne kulture u Republici Hrvatskoj. Uzimajući u obzir nultu tolerancu na bilo kakav sadržaj GMO-a u sjemenu, sama analiza usmjerena je isključivo na detekciju s ciljem maksimalne pokrivenosti, uz razuman utrošak resursa i vremena potrebnoga od zaprimanja uzorka do izdavanja analitičkoga izvješća. Rezultati istraživanja ukazuju da matrica probira omogućuje optimalan odabir strategije u analizi uzoraka i daje zadovoljavajući rezultat, a istovremeno su vrijeme analize i financijski trošak unutar prihvatljivih okvira.
THE STRATEGIES IN THE DETECTION OF GENETICALLY MODIFIED ORGANISMS IN THE SEED ON THE TERRITORY OF THE REPUBLIC OF CROATIA: THE APPLICATION OF THE SCREENING METHOD
LITERATURA
Adresa autora - Authors’ address: Primljeno - Received Ksenija Duka, univ. spec. techn. aliment. 19.02.2024
Dr. sc. Renata Hanzer Revidirano - Revised
e-mail: renata.hanzer@hapih.hr 13.03.2024.
Hrvatska agencija za poljoprivredu i hranu Prihvaćeno – Accepted
